题目内容
3.某离子反应中共有H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中C(ClO-)随反应进行逐渐减小.下列判断错误的是( )| A. | 该反应的还原剂是NH4+ | |
| B. | 消耗1mol氧化剂,转移2mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比是2:3 | |
| D. | 反应后溶液酸性明显增强 |
分析 c(NH4+)随反应进行逐渐减小,NH4+应是反应物,N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,
A.N元素的化合价升高,则反应的还原剂是NH4+,故A正确;
B.Cl元素的化合价由+1价降低为-1价,ClO-为氧化剂,则消耗1mol氧化剂,转移电子2mol,故B正确;
C.由反应可知,氧化剂与还原剂的物质的量之比为3:2,故C错误;
D.反应生成H+,溶液酸性增强,故D正确.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
13.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合新的物质.根据上述观点,下列说法不正确的是( )
| A. | PCl3的水解产物是PH3和HCl | B. | CuCl2的水解产物是Cu(OH)2和HCl | ||
| C. | NaClO的水解产物是HClO和NaOH | D. | CaO2的水解产物是Ca(OH)2和H2O2 |
14.下列物质在水溶液中的电离方程式书写正确的是 ( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | Al2 (SO4)3═Al 3++SO42- | D. | Na2SO4═2Na++SO42 |
11.下列说法正确的是( )
| A. | 放热反应在任意条件下都能自发进行 | |
| B. | 已知热化学方程式2A(g)+B(g)?2C (g)△H=-QkJ/mol (Q>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 1mol/L的盐酸与1mol/L的氨水、11mol/L的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多 | |
| D. | BaCl2溶液中加过量H2SO4,溶液中一定不存在Ba2+ |
18.实验室鉴别庚烷、1-庚烯和甲苯,所采用的试剂可以是下列中的( )
| A. | 溴水石蕊溶液 | B. | 氢氧化钠溶液和溴水 | ||
| C. | 溴水和高锰酸钾酸性溶液 | D. | 高锰酸钾溶液 |
8.下列实验操作能够达到实验目的是( )
| A. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 | |
| D. | 在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
15.据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )
| A. | 元素 | B. | 原子 | C. | 分子 | D. | 单质 |
12.能表示阿伏加德罗常数数值的是( )
| A. | 1 mol金属钠含有的电子数 | |
| B. | 0.012 kg 12C中含有的碳原子数 | |
| C. | 1 mol H2SO4完全溶于水后电离出的H+的个数 | |
| D. | 27 g Al与足量稀硫酸反应后生成H2的分子数 |
3.苯甲醇又称为苄醇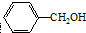 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
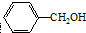 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |