题目内容
20.某实验小组拟用有机物A来合成阿司匹林和M,M是一种防晒剂,结构式为CH3O COOCH2CH2CH(OH3)2.合成路线如下:
COOCH2CH2CH(OH3)2.合成路线如下: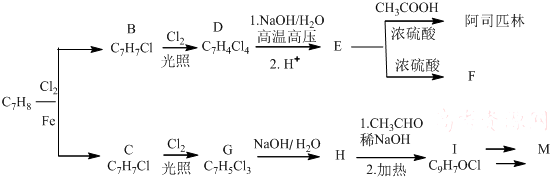
已知:
(1)E的相对分子质量为138
(2)F的相对分子质量为240
(3)通常在同一个碳原子上连有两个羟基不稳定,容易脱水形成羰基
(4)RCHO+R′CH2CHO$\stackrel{稀NaOH}{→}$
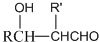 $\stackrel{加热}{→}$H2O+
$\stackrel{加热}{→}$H2O+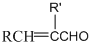
根据以上信息回答下列问题:
(1)写出B的结构简式
 ,由H生成I的第二步反应的反应类型是消去反应.
,由H生成I的第二步反应的反应类型是消去反应.(2)写下列反应的化学方程式D+NaOH(高温高压)
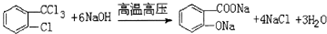 .E→F
.E→F .
.(3)阿司匹林为常用解热镇痛药,试写出两种阿司匹林的同分异构体(要求:苯环上有3个取代基;属于酯类,每摩尔该物质水解消耗4摩尔NaOH;且能发生银镜反应.)
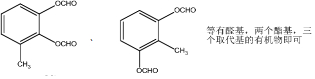 .
.
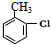
分析 由M的结构简式为 ,可知苯环上有两个对位取代基,则A为甲苯,结构简式为
,可知苯环上有两个对位取代基,则A为甲苯,结构简式为 ,A再催化剂条件下发生苯环取代生成C为
,A再催化剂条件下发生苯环取代生成C为 ,C在光照条件下发生甲基上的取代反应生成G为
,C在光照条件下发生甲基上的取代反应生成G为 ,由信息(3)可知G发生水解反应生成H为
,由信息(3)可知G发生水解反应生成H为 ,H与乙醛发生信息(4)中的反应生成I为
,H与乙醛发生信息(4)中的反应生成I为 .
.
阿斯匹林结构简式为 ,则B为
,则B为 、D为
、D为 .由信息(3)可知E为
.由信息(3)可知E为 ,E相对分子质量为138,F相对分子质量为240,说明2分子E在浓硫酸作用下发生酯化反应生成F为
,E相对分子质量为138,F相对分子质量为240,说明2分子E在浓硫酸作用下发生酯化反应生成F为 和2分子水,以此来解答.
和2分子水,以此来解答.
解答 解:(1)由上述分析可知,B的结构简式为 ,由H生成I,先加成后消去,第二步反应的反应类型是消去反应,故答案为:
,由H生成I,先加成后消去,第二步反应的反应类型是消去反应,故答案为: ;消去反应;
;消去反应;
(2)D与NaOH在高温高压下的反应方程式为 ;
;
E→F的反应方程式为 ,
,
故答案为: ;
; ;
;
(3)阿司匹林为 ,两种阿司匹林的同分异构体满足苯环上有3个取代基、属于酯类(含-COOC-),每摩尔该物质水解消耗4摩尔NaOH,且能发生银镜反应(含-CHO),则存在2个甲酸苯酚酯结构,且苯环上连接1个甲基,满足条件的结构简式为
,两种阿司匹林的同分异构体满足苯环上有3个取代基、属于酯类(含-COOC-),每摩尔该物质水解消耗4摩尔NaOH,且能发生银镜反应(含-CHO),则存在2个甲酸苯酚酯结构,且苯环上连接1个甲基,满足条件的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、碳链骨架、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
6.氢化亚铜(CuH)是一种难溶物,能在Cl2中燃烧生成CuCl2和HCl,与盐酸反应生成CuCl和H2.下列关于氢化亚铜的推断正确的是( )
| A. | CuH与盐酸的反应属于置换反应 | |
| B. | CuH在Cl2中燃烧,1molCuH转移电子数为2NA | |
| C. | CuH在Cl2中燃烧时铜元素和氢元素均被氧化 | |
| D. | CuH与盐酸反应的离子方程式:H-+H+═H2↑ |
7.反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
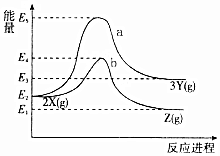

| A. | X→Y反应的活化能为E5 | |
| B. | 加入催化剂曲线a变为曲线b | |
| C. | 升高温度增大吸热反应的活化能,从而使化学反应速率加快 | |
| D. | 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快 |
8.氨和铵盐既是实验室常用试剂又是重要化工原料.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.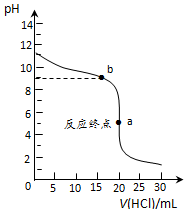
①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O
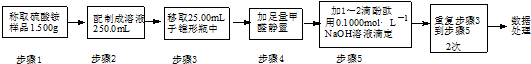
滴定结果如表所示:
试计算该样品中氮元素的质量分数(写出计算过程)计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.

①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O

滴定结果如表所示:
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
12.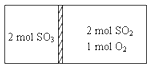 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )| A. | 恒温条件下,达到平衡容器两边SO3的体积分数相同 | |
| B. | 恒温条件下,容器中两边的吸收或放出的热量数值之和小于为196kJ | |
| C. | 若容器为绝热,达到平衡时右室反应速率等于左室反应速率 | |
| D. | 若容器为绝热容器,右室中SO2的转化率与左室SO3的转化率之和小于1 |
10.足量浓硫酸与mg铜反应得到标准状况下SO2nL,则被还原的酸是( )
| A. | $\frac{m}{32}$ mol | B. | $\frac{2m}{64}$ mol | C. | $\frac{98n}{22.4}$ g | D. | $\frac{64n}{22.4}$g |