题目内容
9.有下列五种溶液:(a)pH=11的NaOH,(b)pH=11的Ca(OH)2,(c)pH=3的H2SO4,(d)pH=3的HF,(e)1×10-3mol/L CH3COOH.溶质的物质的量浓度最大.a和c或b和c等体积混合后,溶液呈中性.
a和e等体积混合,反应后溶液呈碱性.
b和c等体积混合,反应后溶液呈中性.
分析 (a)pH=11的NaOH为强碱溶液,氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,溶质浓度10-3mol/L,
(b)pH=11的Ca(OH)2,为强碱溶液,氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,溶质浓度为:5×10-4mol/L,
(c)pH=3的H2SO4,为强酸溶液,氢离子浓度10-3mol/L,溶质浓度为5×10-4mol/L,
(d)pH=3的HF为弱酸溶液,平衡状态下氢离子浓度为氢离子浓度10-3mol/L,溶质浓度大于10-3mol/L,
(e)1×10-3mol/L CH3COOH溶液中氢离子浓度小于1×10-3mol/L.
解答 解:(a)pH=11的NaOH为强碱溶液,氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,溶质浓度10-3mol/L,
(b)pH=11的Ca(OH)2,为强碱溶液,氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,溶质浓度为:5×10-4mol/L,
(c)pH=3的H2SO4,为强酸溶液,氢离子浓度10-3mol/L,溶质浓度为5×10-4mol/L,
(d)pH=3的HF为弱酸溶液,平衡状态下氢离子浓度为氢离子浓度10-3mol/L,溶质浓度大于10-3mol/L,
(e)1×10-3mol/L CH3COOH溶液中氢离子浓度小于1×10-3mol/L,
溶质的物质的量浓度最大的为(d),强酸强碱前后中和溶液显中性,(a)和(c),(b)和(c)等体积混合后,溶液呈中性,
a为pH=11的NaOH和1×10-3mol/L CH3COOH等调节反应生成醋酸钠,溶液中醋酸根离子水解溶液显碱性,
b为pH=11的Ca(OH)2和pH=3的HF的溶液反应后,HF又电离出氢离子溶液显酸性,和pH=3的H2SO4等体积混合溶液呈中性,
故答案为:d;a c;b c; e;c.
点评 本题考查了酸碱反应后溶液酸碱性的分析判断,注意弱酸、弱碱溶液中存在的电离平衡,等浓度混合和等PH等体积混合后溶液酸碱性的分析判断是解题关键,题目难度中等.

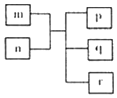 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | 简单气态氢化物沸点Y>Z | |
| D. | X、Z、W三种元素可以形成离子化合物 |
| A. | 已知一个H2分子的体积是VL,则H2的摩尔体积是VNA L/mol | |
| B. | 肼(N2H4),熔点20℃,沸点113.5℃,标况下,11.2L肼的原子数小于3NA | |
| C. | 25℃、101KPa下,16gNH2-含有10NA个电子 | |
| D. | 标况下,4gH2、11.2LO2、1molSO3中O2体积最小 |
| A. | 使酚酞溶液变红的溶液:H+、C1-、NO3-、Ba2+ | |
| B. | 澄清透明的溶液:MnO4-、Al3+、SO42-、K+ | |
| C. | 强碱性溶液:K+、Mg2+、HCO3-、NO3- | |
| D. | 无色的溶液:CO32-、SO42-、Cu2+、NH4+ |
 COOCH2CH2CH(OH3)2.合成路线如下:
COOCH2CH2CH(OH3)2.合成路线如下:
 $\stackrel{加热}{→}$H2O+
$\stackrel{加热}{→}$H2O+
 ,由H生成I的第二步反应的反应类型是消去反应.
,由H生成I的第二步反应的反应类型是消去反应. .E→F
.E→F .
. .
.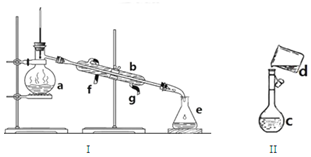 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.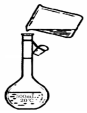 用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题