题目内容
14.在下列给定条件的溶液中,一定能大量共存的离子组是( )| A. | 在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、I-、SCN- | |
| C. | pH=13的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、NO3- |
分析 A.[Al(OH)4]-与铵根离子、氢离子反应;
B.铁离子与碘离子、硫氰根离子反应;
C.pH=13的溶液中存在大量氢氧根离子,铵根离子与氢氧根离子反应;
D.该溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:A.[Al(OH)4]-与NH4+、H+反应,在溶液中不能大量共存,故A错误;
B.Fe3+与I-、SCN-反应,在溶液中不能大量共存,故B错误;
C.pH=13的溶液呈碱性,溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.由水电离产生的c(OH-)=1×10-12mol•L-1的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,K+、Na+、Cl-、NO3-之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
17.某物质 R是人类生命不可缺少的物质.已知 R的摩尔质量为 150g/mol,其中含碳元素 40%,含氢元素 6.7%,其余为氧元素.则 R的化学式为( )
| A. | C5H10O2 | B. | C5H10O5 | C. | C6H6O | D. | C6H12O6 |
9.下列对如图两烧杯溶液分析一定正确的是( )
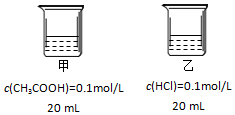

| A. | 甲、乙两烧杯中水电离出的H+浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件下,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向甲烧杯加入NaOH使溶液中性后一定存在:c(Na+)=c(CH3COO-)+c(CH3COOH) |
19. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )| A. | 碳酸钠溶液 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |
6.在容积不变的密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
①平衡不发生移动; ②平衡向正反应方向移动;③平衡向逆反应方向移动;④NH3的质量分数增加;⑤正逆反应速率都增大.
①平衡不发生移动; ②平衡向正反应方向移动;③平衡向逆反应方向移动;④NH3的质量分数增加;⑤正逆反应速率都增大.
| A. | ①⑤ | B. | ③④ | C. | ②④ | D. | ②④⑤ |
3.下列说法正确的是( )
| A. | 乙烯的电子式为  | B. | 乙烯的球棍模型为  | ||
| C. | 乙烯分子是平面结构 | D. | 乙烯的结构简式为CH2CH2 |
 如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生.
如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生.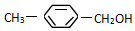 类别醇类或芳香醇.官能团的结构简式-OH名称羟基.
类别醇类或芳香醇.官能团的结构简式-OH名称羟基.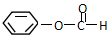 类别酯类.官能团的结构简式-COOC-名称酯基.
类别酯类.官能团的结构简式-COOC-名称酯基.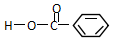 类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.
类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.