题目内容
欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数.资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在
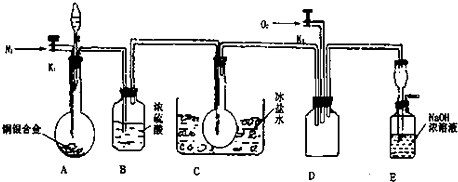
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 .
(2)装置B瓶的作用是 .
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是 ;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人 (填“冷”或“热”)的氧气.
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是: .
(5)实验测得下列数据:所用铜银合金质量为15.0g,浓硝酸的体积为40mL,浓度为13.5mol?L-1.实验后:A中溶液体积为40mL,H+浓度为1.0mol?L-1.若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为 ;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是 .
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程 .

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是
(2)装置B瓶的作用是
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是:
(5)实验测得下列数据:所用铜银合金质量为15.0g,浓硝酸的体积为40mL,浓度为13.5mol?L-1.实验后:A中溶液体积为40mL,H+浓度为1.0mol?L-1.若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中 冷却后水和二氧化氮反应生成一氧化氮;
(3)一氧化氮和氧气反应生成红棕色气体二氧化氮气体;温度高反应速率快;
(4)由于装置中有残留的气体,所以要打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.5mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量,所以还需要测量C中烧烧瓶在实验前后增加的质量;
(6)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中 冷却后水和二氧化氮反应生成一氧化氮;
(3)一氧化氮和氧气反应生成红棕色气体二氧化氮气体;温度高反应速率快;
(4)由于装置中有残留的气体,所以要打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.5mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量,所以还需要测量C中烧烧瓶在实验前后增加的质量;
(6)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数;
解答:
解:(1)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;
故答案为:排尽装置中的空气;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,
故答案为:吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应产生NO;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,通入氧气温度越高反应速率越快,通入热的氧气,
故答案为:出现红棕色气体;热;
(4)由于装置中有残留的气体,所以在A中反应完成和D中出现现象后还须进行的操作是:打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
故答案为:打开K1、K2持续通入一段时间的N2和O2;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.50mol,
故答案为:0.50mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量.所以还需要测量C中烧烧瓶在实验前后增加的质量,
故答案为:C中圆底烧瓶在实验前后增加的质量;
(6)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数,在反应后的混合溶液中A中加入过量的NaCl溶液,过滤后,将沉淀洗涤、干燥,最后称取所得的AgCl沉淀的质量,再进行计算;
故答案为:在反应后的混合溶液中A中加入过量的NaCl溶液,过滤后,将沉淀洗涤、干燥,最后称取所得的AgCl沉淀的质量,再进行计算.
故答案为:排尽装置中的空气;
(2)B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,
故答案为:吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应产生NO;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,通入氧气温度越高反应速率越快,通入热的氧气,
故答案为:出现红棕色气体;热;
(4)由于装置中有残留的气体,所以在A中反应完成和D中出现现象后还须进行的操作是:打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
故答案为:打开K1、K2持续通入一段时间的N2和O2;
(5)①硝酸的总的物质的量是0.54mol,剩余硝酸是0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.50mol,
故答案为:0.50mol;
②要计算铜质量分数,还需要计算出生成的N2O4的质量.所以还需要测量C中烧烧瓶在实验前后增加的质量,
故答案为:C中圆底烧瓶在实验前后增加的质量;
(6)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数,在反应后的混合溶液中A中加入过量的NaCl溶液,过滤后,将沉淀洗涤、干燥,最后称取所得的AgCl沉淀的质量,再进行计算;
故答案为:在反应后的混合溶液中A中加入过量的NaCl溶液,过滤后,将沉淀洗涤、干燥,最后称取所得的AgCl沉淀的质量,再进行计算.
点评:本题考查了物质性质的实验设计,硝酸性质的应用,实验步骤和产物性质及其反应现象是解题关键,题目难度中等.

练习册系列答案
相关题目
X、Y、Z三种主族元素,已知X+和Y-具有相同电子层结构,Z元素原子核电荷数比Y元素原子核电荷数少9,Y-在一定条件下可被氧化成YZ3-,则下列说法正确的是( )
| A、X、Y、Z均属于短周期元素 |
| B、离子半径X+>Y- |
| C、Y的气态氢化物可形成氢键 |
| D、X、Y、Z三种元素组成的化合物中既含有离子键又含有共价键 |
根据下列转化关系,填写下列空白

测知B在标准状况时密度为1.25g/L.
(1)反应①属于 反应;
(2)有机物C的名称为 ;
(3)写出第③④步反应的化学方程式 , ;
(4)比C多一个碳原子的同系物有 种.

测知B在标准状况时密度为1.25g/L.
(1)反应①属于
(2)有机物C的名称为
(3)写出第③④步反应的化学方程式
(4)比C多一个碳原子的同系物有
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池.已知通入甲烷的一极,其电极反应为:CH4+10OH--8e-=CO32-+7H2O;下列叙述不正确的是( )
| A、通入甲烷的一极为负极 |
| B、通入氧气的一极发生还原反应 |
| C、该电池总反应为:CH4+2O2+2OH-=CO32-+3H2O |
| D、该电池在工作时,溶液中的阴离子向正极移动 |
对③装置叙述正确的是( )
| A、Fe作正极,Zn作负极 |
| B、Fe处发生的反应为:Fe+Cu2+═Fe2++Cu |
| C、Fe作负极,Zn作正极 |
| D、Zn处发生的反应为:Zn+Cu2+═Zn2++Cu |
下列关于原电池的叙述正确的是( )
| A、构成原电池的正极和负极必须是两种不同的金属 |
| B、原电池是将化学能转变为电能的装置 |
| C、原电池中电子流出的一极是负极,该极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: