题目内容
水(H2O)在很多化学反应中起及其重要的作用,请研究下列有水参与的氧化还原反应:
①NaH+H2O=NaOH+H2↑ ②2Na+2H2O=2NaOH+H2↑
③3NO2+H2O=2HNO3+NO ④2F2+2H2O=4HF+O2
⑤2Na2O2+2H2O=4NaOH+O2↑ ⑥2H2O
2H2↑+O2↑
(1)水只做氧化剂的是 (填序号,下同),水只做还原剂的是 ;水既做氧化剂,又做还原剂的是 ;水既不是氧化剂,又不是还原剂的是 .
(2)水作还原剂时,被氧化的元素是 ,水作氧化剂时,被还原的元素是 .
①NaH+H2O=NaOH+H2↑ ②2Na+2H2O=2NaOH+H2↑
③3NO2+H2O=2HNO3+NO ④2F2+2H2O=4HF+O2
⑤2Na2O2+2H2O=4NaOH+O2↑ ⑥2H2O
| ||
(1)水只做氧化剂的是
(2)水作还原剂时,被氧化的元素是
考点:氧化还原反应
专题:
分析:(1)水只作氧化剂,说明水中元素只得电子化合价降低;水只作还原剂说明水中元素只失电子化合价升高;水既做氧化剂,又做还原剂说明水中元素既有得电子化合价降低的又有失电子化合价升高的;水既不是氧化剂,又不是还原剂,说明水中各元素化合价不变;
(2)水作还原剂时,被氧化的元素化合价升高;水作氧化剂时,被还原的元素化合价降低.
(2)水作还原剂时,被氧化的元素化合价升高;水作氧化剂时,被还原的元素化合价降低.
解答:
解:①NaH+H2O=NaOH+H2↑中NaH中H元素化合价由-1价变为0价、水中H元素化合价由+1价变为0价,所以水只作氧化剂;
②2Na+2H2O=2NaOH+H2↑中Na元素化合价由0价变为+1价、水中H元素化合价由+1价变为0价,所以水只作氧化剂;
③3NO2+H2O=2HNO3+NO中N元素化合价由+4价变为+5价、+2价,水中各元素化合价不变,所以水既不是氧化剂又不是还原剂;
④2F2+2H2O=4HF+O2 中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水只作还原剂;
⑤2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,水中各元素化合价不变,则水既不是氧化剂又不是还原剂;
⑥2H2O
2H2↑+O2↑中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以水既是氧化剂又是还原剂;
(1)水只做氧化剂的是①②,水只做还原剂的是④;水既做氧化剂,又做还原剂的是⑥;水既不是氧化剂,又不是还原剂的是③⑤;
故答案为:①②;④;⑥;③⑤;
(2)水作还原剂时,O元素化合价由-2价变为0价,所以被氧化的元素是O;水作氧化剂时,H元素化合价由+1价变为0价,所以被还原的元素是H,
故答案为:O;H.
②2Na+2H2O=2NaOH+H2↑中Na元素化合价由0价变为+1价、水中H元素化合价由+1价变为0价,所以水只作氧化剂;
③3NO2+H2O=2HNO3+NO中N元素化合价由+4价变为+5价、+2价,水中各元素化合价不变,所以水既不是氧化剂又不是还原剂;
④2F2+2H2O=4HF+O2 中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水只作还原剂;
⑤2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,水中各元素化合价不变,则水既不是氧化剂又不是还原剂;
⑥2H2O
| ||
(1)水只做氧化剂的是①②,水只做还原剂的是④;水既做氧化剂,又做还原剂的是⑥;水既不是氧化剂,又不是还原剂的是③⑤;
故答案为:①②;④;⑥;③⑤;
(2)水作还原剂时,O元素化合价由-2价变为0价,所以被氧化的元素是O;水作氧化剂时,H元素化合价由+1价变为0价,所以被还原的元素是H,
故答案为:O;H.
点评:本题考查氧化还原反应,侧重基本概念,明确元素化合价变化是解本题关键,熟练掌握常见元素化合价,注意氟气和水的反应、过氧化钠中O元素化合价,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、物质发生化学反应都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
| D、凡是经过加热而发生的化学反应都是吸热反应 |
设NA为阿伏加德罗常数的数值,下列说法中,正确的是( )
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
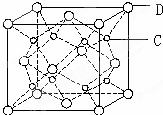 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则: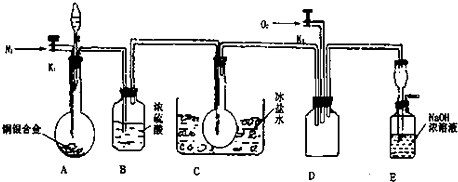
 实验室制取乙烯:C2H5OH
实验室制取乙烯:C2H5OH 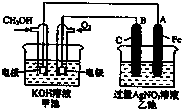 目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.
目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.