题目内容
对③装置叙述正确的是( )
| A、Fe作正极,Zn作负极 |
| B、Fe处发生的反应为:Fe+Cu2+═Fe2++Cu |
| C、Fe作负极,Zn作正极 |
| D、Zn处发生的反应为:Zn+Cu2+═Zn2++Cu |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Zn比Fe活泼,为原电池的负极,Fe为正极,原电池工作时,负极发生氧化反应生成Zn2+,正极Cu2+被还原生成Cu,以此解答该题.
解答:
解:③装置为Zn、Fe原电池,Zn比Fe活泼,为原电池的负极,负极发生氧化反应生成Zn2+,电极方程式为Zn-2e-=Zn2+,Fe为正极,正极Cu2+被还原生成Cu,电极方程式为Cu2++2e-=Cu,只有A正确.
故选A.
故选A.
点评:本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极方程式的书写,为解答该类题目的关键,难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法中,正确的是( )
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)?2Z(g),经60s达到平衡,生成0.4mol Z.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
| B、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
D、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
|
下列有机物命名正确的是( )
| A、2-甲基-3-乙基丁烷 |
| B、1,5-二甲苯 |
| C、2,2-二甲基-1-丁烯 |
| D、3-甲基-1-丁烯 |
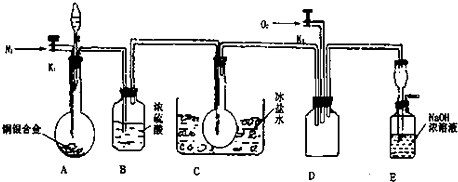
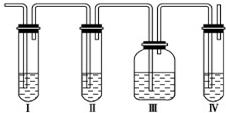 实验室制取乙烯:C2H5OH
实验室制取乙烯:C2H5OH