题目内容
13.已知氯化钠在某温度下的溶解度为35g,则该温度下,氯化钠饱和溶液的质量分数为25.9%.若测得该饱和溶液的密度为1.2g/cm3,则该饱和溶液的物质的量浓度为5.32mol/L.分析 该温度下NaCl溶液的质量分数=$\frac{S}{S+100}$×100%,该饱和溶液的物质的量浓度=$\frac{1000ρω}{M}$.
解答 解:某温度下NaCl的溶解度为35g,则该温度下NaCl溶液的质量分数=$\frac{S}{S+100}$×100%=$\frac{35g}{35g+100g}$×100%=25.9%,该饱和溶液的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.2×25.9%}{58.5}$mol/L=5.32mol/L,
故答案为:25.9%;5.32.
点评 本题考查物质的量浓度的有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,注意物质的量浓度公式中单位换算,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列表示方法中,错误的是( )
| A. | 1mol氮 | B. | 1molO | C. | 1molNa+ | D. | 1molH2CO3 |
8.下列有关叙述中正确的是( )
| A. | 同一弱电解质溶液,温度不同时,导电能力相同 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 强电解质在水溶液中的电离过程是不可逆的 | |
| D. | 易溶于水的电解质一定是强电解质 |
18.K、Ka、KW、KSp分别表示化学平衡常数、电离常数、水的离子积常数和溶度积常数,下列判断正确的是( )
| A. | 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大 | |
| B. | 相同温度下的酸、碱、盐的稀溶液中水的离子积常数KW不同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 室温下K(HCN)<K(CH3COOH),等浓度的HCN和CH3COOH溶液pH较小的为CH3COOH |
5.一定量的Fe与过量的盐酸反应制取氢气,下列措施中可加快反应速率的是( )
| A. | 加10mL水 | B. | 增大压强 | C. | 降低温度 | D. | CuSO4晶体 |
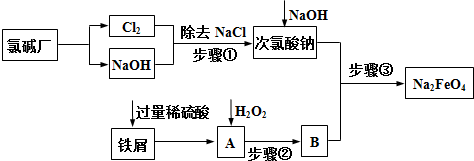
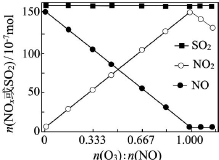 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: