题目内容
5.一定量的Fe与过量的盐酸反应制取氢气,下列措施中可加快反应速率的是( )| A. | 加10mL水 | B. | 增大压强 | C. | 降低温度 | D. | CuSO4晶体 |
分析 用铁与稀盐酸反应制取氢气时,增大氢离子的浓度、升高温度、增大接触面积等可加快反应速率,以此来解答.
解答 解:A.加入水,浓度减小,反应速率减小,故A错误;
B.反应在溶液中进行,增大压强,浓度不变,反应速率不变,故B错误;
C.降低温度,反应速率减小,故C错误;
D.铁置换出铜,形成原电池反应,增大反应速率,故D正确.
故选D.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于双基的考查,明确温度、浓度、催化剂对反应的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
15.摩尔质量的单位是( )
| A. | g | B. | g/mol | C. | mol/g | D. | mol |
16.下列叙述正确的是( )
| A. | 一定条件下,气体体积大小取决于气体分子的大小 | |
| B. | 一定条件下,气体体积大小取决于其物质的量的多少 | |
| C. | 1mol任何气体所占的体积为22.4L,称为气体摩尔体积 | |
| D. | 体积不相等的两种气体所含的分子数也一定不相等 |
17.某元素R有两种同位素10R与11R,已知R元素的近似相对原子质量为10.8,该元素的两种同位素原子的物质的量之比为( )
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 2:3 |
16.下列物质中,既有离子键又有共价键的是( )
| A. | CaCl2 | B. | Na2S | C. | H2O | D. | NH4F |
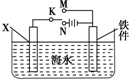 钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
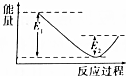
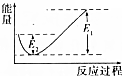
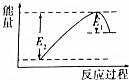
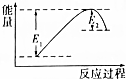
钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.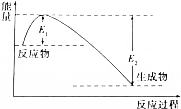 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )