题目内容
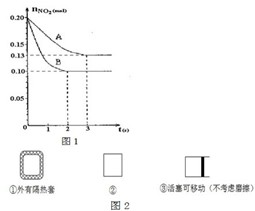 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.V值不同
(2)写出该反应的化学平衡常数K的表达式:
(3)在图1上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率
v(O2)=
(4)不能说明该反应已达到平衡状态的是
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图2所示的三个容积相同的三个容器①、②、③进行反应:2NO+O?2NO2
若起始温度相同,分别向三个容器中充入2molNO和1molO2,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号)
考点:物质的量或浓度随时间的变化曲线,化学平衡建立的过程,化学平衡常数的含义,化学平衡状态的判断
专题:化学平衡专题
分析:(1)由图象可知B状态反应较快,且A、B处于不同平衡状态,B状态NO2的物质的量较少,结合温度、压强对平衡移动的影响判断;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算,结合温度对平衡移动的影响判断;
(3)根据NO2的物质的量结合方程式可判断平衡时O2的浓度,进而可计算O2的反应速率;
(4)达到平衡时存在“等”、“定”的特征,由此可判断平衡状态;
(5)2NO+O2?2NO2由(1)的推断可知该反应为放热反应,根据温度压强对平衡的影响分析.
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算,结合温度对平衡移动的影响判断;
(3)根据NO2的物质的量结合方程式可判断平衡时O2的浓度,进而可计算O2的反应速率;
(4)达到平衡时存在“等”、“定”的特征,由此可判断平衡状态;
(5)2NO+O2?2NO2由(1)的推断可知该反应为放热反应,根据温度压强对平衡的影响分析.
解答:
解:(1)由图象可知B状态反应较快,且A、B处于不同平衡状态,肯定不是催化剂的影响,如是压强的影响,则增大压强,平衡向逆反应方向移动,则NO2的物质的量应增大,但B状态NO2的物质的量较少,应是升高温度的原因,该反应的正反应为吸热反应,升高温度平衡向正反应方向移动,则NO2的物质的量减少,故答案为:B;
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
,反应的正反应为吸热反应,升高温度平衡向正反应方向移动,则平衡常数增大,
故答案为:k=
;<;
(3)根据图象可知,B状态时,平衡时NO2的物质的量为0.1mol,则反应的NO2的物质的量为0.1mol,生成O2的物质的量为0.05mol,则VO2=
=
mol/(L?s),故答案为:
mol/(L?s);
(4)A.V正(NO2)=V逆(NO),说明正逆反应速率相等,反应达到平衡状态,故A正确;
B.C(NO2)=C(NO),正逆反应速率不相等,没有达到平衡状态,故B错误;
C.气体的质量不变,气体的平均摩尔质量不变,则说明气体的物质的量不变,说明反应达到平衡状态,故C正确;
D.由于气体的质量不变,气体的体积不变,则无论是否达到平衡状态,都存在气体的密度保持不变的特征,不能判断是否达到平衡,故D错误;
故答案为:BD;
(5)2NO+O2?2NO2由(1)的推断可知该反应为放热反应,容器①外面有隔热套,反应放热则容器内温度升高,平衡逆移,NO物质的百分含量增大;容器③有自由移动的活塞,容器内为恒压状态,而容器②体积不变反应后气体物质的量减少,压强减小,所以容器③的压强大于容器②的压强,所以容器③内向正方向进行的程度大,NO物质的百分含量减小,所以NO物质的百分含量由大到小的顺序为①②③,故答案为:①②③.
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
| c2(NO)?c(O2) |
| c2(NO2) |
故答案为:k=
| c2(NO)?c(O2) |
| c2(NO2) |
(3)根据图象可知,B状态时,平衡时NO2的物质的量为0.1mol,则反应的NO2的物质的量为0.1mol,生成O2的物质的量为0.05mol,则VO2=
| 0.05mol | ||
|
| 0.025 |
| V |
| 0.025 |
| V |
(4)A.V正(NO2)=V逆(NO),说明正逆反应速率相等,反应达到平衡状态,故A正确;
B.C(NO2)=C(NO),正逆反应速率不相等,没有达到平衡状态,故B错误;
C.气体的质量不变,气体的平均摩尔质量不变,则说明气体的物质的量不变,说明反应达到平衡状态,故C正确;
D.由于气体的质量不变,气体的体积不变,则无论是否达到平衡状态,都存在气体的密度保持不变的特征,不能判断是否达到平衡,故D错误;
故答案为:BD;
(5)2NO+O2?2NO2由(1)的推断可知该反应为放热反应,容器①外面有隔热套,反应放热则容器内温度升高,平衡逆移,NO物质的百分含量增大;容器③有自由移动的活塞,容器内为恒压状态,而容器②体积不变反应后气体物质的量减少,压强减小,所以容器③的压强大于容器②的压强,所以容器③内向正方向进行的程度大,NO物质的百分含量减小,所以NO物质的百分含量由大到小的顺序为①②③,故答案为:①②③.
点评:本题考查较为综合,涉及化学平衡的计算,外界条件对平衡移动的影响以及平衡状态的判断,题目难度中等.

练习册系列答案
相关题目
相等质量的两块铝,分别和足量的稀H2SO4和NaOH反应,产生气体在相同条件下的体积比( )
| A、2:3 | B、3:2 |
| C、2:1 | D、1:1 |
在同温同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子数相等,则两个容器的体积之比是( )
| A、2:1 | B、1:5 |
| C、2:3 | D、5:1 |
 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图 所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图 所示.下列叙述中不正确的是( )| A、MOH是一种弱碱 |
| B、在x点,c(M+)=c(R+) |
| C、在x点,ROH完全电离 |
| D、稀释前,c(ROH)=10 c(MOH) |
下列离子方程式中,正确的是( )
| A、稀硫酸与NaOH溶液反应2H++OH-=H2O |
| B、AgNO3溶液与NaCl溶液反应 Ag++Cl-=AgCl↓ |
| C、CaCO3与稀盐酸反应 CO32-+2H+=CO2↑+H2O |
| D、Fe片插入FeCl3溶液中 Fe+Fe3+=2Fe2+ |
 某离子晶体的晶胞结构如图所示,则该离子晶体的化学式为( )
某离子晶体的晶胞结构如图所示,则该离子晶体的化学式为( )| A、AB12C8 |
| B、ABC3 |
| C、AB2C3 |
| D、AB3C |
在Na2CO3溶液中,下列离子浓度关系不正确的是( )
| A、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| C、c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D、c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) |

