题目内容
相等质量的两块铝,分别和足量的稀H2SO4和NaOH反应,产生气体在相同条件下的体积比( )
| A、2:3 | B、3:2 |
| C、2:1 | D、1:1 |
考点:化学方程式的有关计算,铝的化学性质
专题:计算题
分析:发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因酸、碱都是足量的,则铝完全反应,铝的质量相等,则生成的氢气的量相等.
解答:
解:由2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑可知,
2molAl分别与足量酸、碱反应都生成3molH2,
则两份等量的铝粉分别与足量酸、碱反应生成等量的氢气,则相同状态下产生的气体体积之比是1:1,
故选D.
2molAl分别与足量酸、碱反应都生成3molH2,
则两份等量的铝粉分别与足量酸、碱反应生成等量的氢气,则相同状态下产生的气体体积之比是1:1,
故选D.
点评:本题考查学生利用酸碱与铝的反应进行计算,明确发生的化学反应、金属Al完全反应是解答本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图是某有机物分子的简易球棍模型,该有机物中中含C、H、O、N四种元素.下列关于该有机物的说法中错误的是( )
如图是某有机物分子的简易球棍模型,该有机物中中含C、H、O、N四种元素.下列关于该有机物的说法中错误的是( )| A、分子式为C3H7O2N |
| B、能发生取代反应 |
| C、能通过聚合反应生成高分子化合物 |
| D、不能跟NaOH溶液反应 |
在水溶液中能大量共存的一组离子是( )
| A、Fe2+、Al3+、ClO-、Cl- |
| B、K+、Ba2+、OH-、NO3- |
| C、NH4+、Na+、OH-、SO42- |
| D、Mg2+、H+、SiO32-、SO42- |
下列归纳或类推中,正确的是( )
| A、将氯化氢和SO2分别通入石蕊试液中,溶液都变为红色,所以它们都是酸类物质 |
| B、中和反应生成盐和水,有盐和水生成的反应一定是中和反应 |
| C、一氧化碳和氢气都能夺取氧化铜中的氧,它们都具有还原性 |
| D、离子是带电荷的原子或原子团,所以带电荷的微粒一定是离子 |
关于3mol CO2的说法正确的是( )
| A、质量为44g |
| B、有6mol O |
| C、分子数为6.02×1023 |
| D、相对分子质量为44g/mol |
200℃时,11.6g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6g,再将反应后剩余固体冷却后加入含有Na+、HCO3-、SO32-、CO32-等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是( )
| A、原混合气体的平均摩尔质量为23.2g/mol |
| B、混合气体与Na2O2反应过程中电子转移的物质的量为0.25mol |
| C、溶液中SO32-的物质的量浓度基本保持不变 |
| D、溶液中HCO3-的物质的量浓度减小,CO32-的物质的量浓度增大,但是HCO3-和CO32-的物质的量浓度之和基本保持不变 |
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、16 g CH4中含有4 nA个C-H键 |
| B、1 mol/L NaCl溶液含有nA个Na+ |
| C、1 mol Cu和足量稀硝酸反应产生nA个NO分子 |
| D、标准状况下,22.4 L 己烯中含有nA个己烯分子 |
a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
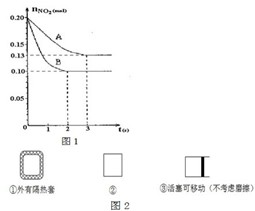 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.