题目内容
8.欲配制1.00mol/L的NaCl溶液80mL,下列说法正确的是( )| A. | 应选用100mL容量瓶 | |
| B. | 配置之前容量瓶中残留的蒸馏水会导致浓度偏高 | |
| C. | 定容时腐蚀刻度会导致浓度偏低 | |
| D. | 摇匀、静置后发现凹液面低于刻度线,再加水至刻度线即可 |
分析 依据“大而近”原则选择容量瓶规格;
分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:A.配制1.00mol/L的NaCl溶液80mL,应选择100mL容量瓶,故A正确;
B.配制之前容量瓶中残留的蒸馏水对溶质的物质的量和溶液体积都不会产生影响,依据C=$\frac{n}{V}$可知溶液浓度不变,故B错误;
C.定容时俯视刻度会导致溶液体积偏小,则溶液的物质的量浓度偏高,故C错误;
D.摇匀、静置后发现凹液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制过程及配制原理是解题关键,注意依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.

练习册系列答案
相关题目
18.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )
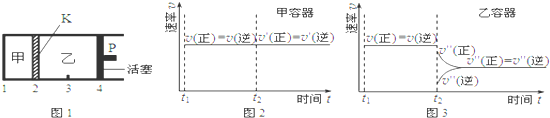

| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
19.海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
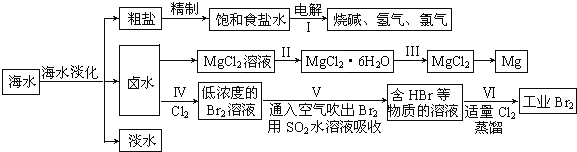
(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).
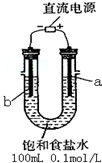
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是ad(填序号,下同),加入e调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(三)制取工业溴:
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.

(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).

(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
16.下列事实不能用勒夏特列原理解释的是( )
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
3.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+.取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红、红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列说法正确的是( )
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
13.已知2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO(g) 与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 | |
| B. | 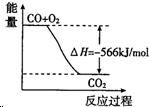 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol | |
| D. | CO的燃烧热为283kJ |
17.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 碳酸氢钠溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COO Na 溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2 c(Na+) | |
| C. | 硫酸铜溶液与过量浓氨水反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2 NH4+ | |
| D. | 一定浓度的盐酸和氨水混合可能出现c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
18.标准状态下,气态分子断开1mol化学键的焓变称为键焓.已知H-H、H-O和O═O键的键焓△H分别为436kJ•mol - 1、463kJ•mol - 1和495kJ•mol - 1.下列热化学方程式正确的是( )
| A. | H 2O(g)═H 2(g)+O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |

