题目内容
3.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+.取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红、红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列说法正确的是( )| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为:0.02mol,根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,
A.由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为:2×0.02mol=0.04mol,据电荷守恒可知溶液中必然大量存在另一种阴离子Cl-,还可能存在K+,所以至少存在4种离子,故A错误;
B.根据分析可知,该溶液中一定不存在CO32-,故B错误;
C.由电荷守恒可知,Cl-一定存在,且c(Cl-)≥$\frac{0.04mol}{0.1L}$=0.4mol/L,故C正确;
D.该溶液中不一定含有钾离子,所以不一定存在KCl,故D错误;
故选C.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,题目难度中等,试题侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列各组元素中,第一电离能大小次序不正确的是( )
| A. | Mg>Al | B. | S<P | C. | K<Cs | D. | Br<Cl |
18.下列有关Al(OH)3的图象不正确的是( )
| A. | 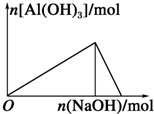 向AlCl3溶液中滴加NaOH溶液 | B. |  向NaOH溶液中滴加AlCl3溶液 | ||
| C. | 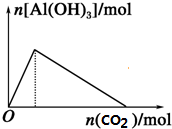 向NaAlO2溶液中滴加CO2 | D. |  向AlCl3溶液中滴氨水 |
8.欲配制1.00mol/L的NaCl溶液80mL,下列说法正确的是( )
| A. | 应选用100mL容量瓶 | |
| B. | 配置之前容量瓶中残留的蒸馏水会导致浓度偏高 | |
| C. | 定容时腐蚀刻度会导致浓度偏低 | |
| D. | 摇匀、静置后发现凹液面低于刻度线,再加水至刻度线即可 |
15.在某密闭容器中,通入一定量的NO2,发生反应:2NO2(g)?N2O4(g)△H<0.下列叙述中正确的是( )
| A. | 恒温恒容,达平衡后再充入N2O4气体,NO2百分含量变小 | |
| B. | 增大压强,平衡向正反应方向移动,混合气体颜色变浅 | |
| C. | 达平衡后,升高温度,△H减小 | |
| D. | 2v正(NO2)═v逆(N2O4)说明反应达到化学平衡状态 |
12.下列除去杂质的方法正确的是( )
| A. | 除去CO2中混有的CO:通入O2点燃 | |
| B. | 除去铜器表面的铜绿【Cu2(OH)2CO3】:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去FeCl3溶液中的FeCl2杂质,加入足量铁粉,再过滤即可 | |
| D. | 欲除去粗盐中的MgCl2、CaCl2和硫酸盐杂质,可加入的药品顺序:NaOH-Na2CO3-BaCl2-盐酸 |
 可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: .
.