题目内容
18.标准状态下,气态分子断开1mol化学键的焓变称为键焓.已知H-H、H-O和O═O键的键焓△H分别为436kJ•mol - 1、463kJ•mol - 1和495kJ•mol - 1.下列热化学方程式正确的是( )| A. | H 2O(g)═H 2(g)+O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
分析 旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和,据此进行解答.
解答 解:A、水分解是吸热反应,应该△H>0,故A错误;
B、△H=2×463kJ/mol-436kJ/mol-$\frac{1}{2}$×495kJ/mol=242.5kJ/mol,故B错误;
C、氢气燃烧放热,应该△H<0,故C错误;
D、△H=2×436kJ/mol+495kJ/mol-4×463kJ/mol=-485kJ/mol,故D正确.
故选D.
点评 本题考查了热化学方程式的书写、反应热的计算,题目难度中等,注意掌握热化学方程式的书写原则,明确化学键与化学反应中能量变化的关系是解题关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
8.欲配制1.00mol/L的NaCl溶液80mL,下列说法正确的是( )
| A. | 应选用100mL容量瓶 | |
| B. | 配置之前容量瓶中残留的蒸馏水会导致浓度偏高 | |
| C. | 定容时腐蚀刻度会导致浓度偏低 | |
| D. | 摇匀、静置后发现凹液面低于刻度线,再加水至刻度线即可 |
9.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
7.粗盐提纯过程中分别加入Na2CO3和BaCl2以除去CaCl2和Na2SO4,它们的添加顺序是( )
| A. | Na2CO3加在BaCl2前 | B. | Na2CO3加在BaCl2后 | ||
| C. | 同时加 | D. | 无固定顺序 |
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答: 可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: .
.
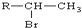 (R为烃基)
(R为烃基) .
.