题目内容
现有如下两个反应:
A.NaOH+HCl=NaCl+H2O
B.2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池:
A. ,B. (选择“能”或“不能”);
(2)如果可以,则写出正、负极材料及其电极反应式:
负极材料 ,电极反应式 ,
正极材料 ,电极反应式 .
A.NaOH+HCl=NaCl+H2O
B.2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池:
A.
(2)如果可以,则写出正、负极材料及其电极反应式:
负极材料
正极材料
考点:设计原电池,原电池和电解池的工作原理
专题:电化学专题
分析:常温下自发进行的氧化还原反应可设计为原电池,A为非氧化还原反应,B中Fe、Cu元素的化合价变化,为氧化还原反应,则B可设计为原电池,B中Cu失去电子作负极,正极材料可选择碳棒,正极上铁离子得到电子,以此来解答.
解答:
解:(1)A.NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为非氧化还原反应,不能设计成原电池;
B.2FeCl3+Cu=2FeCl2+CuCl2中,Fe、Cu元素的化合价变化,为氧化还原反应,则B能设计为原电池,
故答案为:不能;能;
(2)2FeCl3+Cu=2FeCl2+CuCl2中,Cu失去电子,Fe得到电子,则负极为铜,负极反应为Cu-2e-=Cu2+;正极为碳棒,正极反应为2Fe3++2e-=2Fe2+,
故答案为:铜;Cu-2e-=Cu2+;碳;2Fe3++2e-=2Fe2+.
B.2FeCl3+Cu=2FeCl2+CuCl2中,Fe、Cu元素的化合价变化,为氧化还原反应,则B能设计为原电池,
故答案为:不能;能;
(2)2FeCl3+Cu=2FeCl2+CuCl2中,Cu失去电子,Fe得到电子,则负极为铜,负极反应为Cu-2e-=Cu2+;正极为碳棒,正极反应为2Fe3++2e-=2Fe2+,
故答案为:铜;Cu-2e-=Cu2+;碳;2Fe3++2e-=2Fe2+.
点评:本题考查原电池的设计,为高频考点,把握原电池原理与氧化还原反应的关系为解答的关键,注意(2)中正极材料答案不唯一,具有较好的开放性,综合考查学生解决问题的能力,题目难度不大.

练习册系列答案
相关题目
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
| A、Li是负极,电极反应为Li-e-=Li+ |
| B、Li是正极,电极反应为Li+e-=Li- |
| C、MnO2是负极,电极反应为MnO2+e-=MnO2- |
| D、锂电池工作过程:化学能转化为电能 |
下列变化过程中,需要加入氧化剂的是( )
| A、HCl→H2 |
| B、HCl→FeCl2 |
| C、H2SO4→SO2 |
| D、Fe→Fe2O3 |
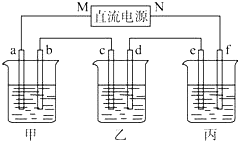 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.