题目内容
已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大.A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍.E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳.回答下列问题:
(1)元素D在周期表中的位置是 .
(2)画出E的阴离子的结构示意图: .
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式: .写出一种由A、C、D三种元素组成的共价化合物的化学式: .
(4)将9g B单质在足量的D单质中燃烧,所得气体通入1L 1mol?L-1 NaOH溶液中,完全吸收后,溶液中大量存在的阴离子是 .
(1)元素D在周期表中的位置是
(2)画出E的阴离子的结构示意图:
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式:
(4)将9g B单质在足量的D单质中燃烧,所得气体通入1L 1mol?L-1 NaOH溶液中,完全吸收后,溶液中大量存在的阴离子是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A是原子半径最小的元素,则A为氢元素;B原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8,故该原子有2个电子层,最外层电子数为4,则B为碳元素;E的单质为黄色晶体,易溶于二硫化碳,E为硫元素,E元素与D元素同主族,则D为氧元素;C、D在元素周期表中处于相邻的位置,C原子序数小于氧元素,则C为氮元素,据此解答.
解答:
解:A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A是原子半径最小的元素,则A为氢元素;B原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8,故该原子有2个电子层,最外层电子数为4,则B为碳元素;E的单质为黄色晶体,易溶于二硫化碳,E为硫元素,E元素与D元素同主族,则D为氧元素;C、D在元素周期表中处于相邻的位置,C原子序数小于氧元素,则C为氮元素,
(1)由上述分析可知,D为O氧元素,处于周期表中第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)E的阴离子为S2-,结构示意图为 ,故答案为:
,故答案为: ;
;
(3)由H、C、N、O四种元素组成的离子化合物的化学式为:NH4HCO3 或(NH4)2CO3,由H、N、O三种元素组成的共价化合物的化学式为:HNO3或HNO2,
故答案为:NH4HCO3 或(NH4)2CO3;HNO3或HNO2;
(4)12g碳单质的物质的量是
=0.75molmol,在足量的氧气中燃烧,生成0.75molCO2,NaOH的物质的量为1L×1mol/L=1mol,二氧化碳与氢氧化钠的物质的量之比为0.75:1=3:4,介于1:2与1:1之间,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,溶液中大量存在的阴离子是HCO3-、CO32-,
故答案为:HCO3-、CO32-.
(1)由上述分析可知,D为O氧元素,处于周期表中第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)E的阴离子为S2-,结构示意图为
 ,故答案为:
,故答案为: ;
;(3)由H、C、N、O四种元素组成的离子化合物的化学式为:NH4HCO3 或(NH4)2CO3,由H、N、O三种元素组成的共价化合物的化学式为:HNO3或HNO2,
故答案为:NH4HCO3 或(NH4)2CO3;HNO3或HNO2;
(4)12g碳单质的物质的量是
| 9g |
| 12g/mol |
故答案为:HCO3-、CO32-.
点评:本题考查结构性质位置关系应用,难度不大,推断元素为解题关键,(4)中注意根据反应物的量确定发生的反应.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
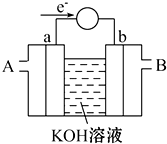
 如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )
如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )| A、a极是负极 |
| B、电子由b通过灯泡流向a |
| C、氢氧燃料电池是环保电池 |
| D、正极的电极反应是:O2+2H2O+4e-=4OH- |
氯元素构成的双原子分子有三种,其相对分子质量分别为70、72、74,此三种分子个数之比为6:3:1.下列说法正确的是( )
| A、氯元素有三种同位素 |
| B、必存在质量数为36的同位素 |
| C、氯气分子的平均相对质量为72 |
| D、质量数最小的氯元素所占原子百分数为百分之75 |

 (1)已知2Cu(s)+
(1)已知2Cu(s)+ A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.