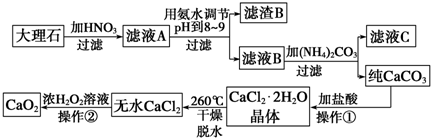
题目内容
4.化学与生活密切相关,下列说法不正确的是( )| A. | “青篙一握,以水二升渍,绞取汁”,该过程是对青篙素的提取,属于化学变化 | |
| B. | 向漂白粉溶液中滴加少量醋酸,漂白速率会加快 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 |
分析 A.依据青篙一握,以水二升渍可知绞取汁,青蒿素的提取用的是低温萃取,属于物理方法;
B.氯酸钙可与酸反应生成具有漂白性的次氯酸;
C.氮和磷是植物的营养元素;
D.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液.
解答 解:A.青蒿素的提取用的是低温萃取,没有新物质生成,属于物理变化,故A错误;
B.醋酸酸性强于次氯酸,向漂白粉溶液中滴加少量醋酸,能够迅速产生次氯酸,漂白速率会加快,故B正确;
C.氮和磷是植物的营养元素,可造成水体富营养化,故C正确;
D.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故D正确;
故选:A.
点评 本题为综合题,考查了化学变化、物理变化区别,强酸制备弱酸的规律,盐类水解应用,题目难度不大,侧重考查学生对基础知识的熟练程度,注意萃取的原理.

练习册系列答案
相关题目
3. 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)关于催化剂在化学反应中的作用,下列叙述正确的是AD(填字母).
A.使反应活化能降低 B.使反应焓变减小 C.使平衡常数增大 D.使反应速率加快
(2)实验①和②的目的是探究反应物浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是:向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
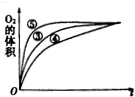
(3)实验③④⑤中,测得生成O2的体积随时间变化关系如图.分析该图可得出的结论是:碱性环境可加快反应速率;酸性环境可减慢反应速率.
 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分 组 实 验 | 催化剂 | |
| ① | 10mL 5%的H2O2溶液 | 无 |
| ② | 10mL 2%的H2O2溶液 | 无 |
| ③ | 10mL 5%的H2O2溶液 | 1mL 0.1mol/L的FeCl3溶液 |
| ④ | 10mL 5%的H2O2溶液+少量盐酸 | 1mL 0.1mol/L的FeCl3溶液 |
| ⑤ | 10mL 5%的H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/L的FeCl3溶液 |
A.使反应活化能降低 B.使反应焓变减小 C.使平衡常数增大 D.使反应速率加快
(2)实验①和②的目的是探究反应物浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是:向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③④⑤中,测得生成O2的体积随时间变化关系如图.分析该图可得出的结论是:碱性环境可加快反应速率;酸性环境可减慢反应速率.
7. 甲苯(
甲苯(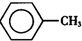 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(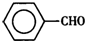 )、苯甲酸(
)、苯甲酸(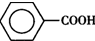 )等
)等
产品.下表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶.
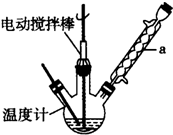
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和
2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯挥发导致产率降低.三颈瓶中发生反应的化学方程式为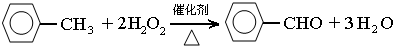 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加人盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000moL/KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.下列情况会使测定结果偏低的是ad(填字母).
a.滴定时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液.
 甲苯(
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等
)等产品.下表列出了有关物质的部分物理性质,请回答:
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和
2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯挥发导致产率降低.三颈瓶中发生反应的化学方程式为
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加人盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000moL/KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.下列情况会使测定结果偏低的是ad(填字母).
a.滴定时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液.
8.按下列的路线制聚氯乙烯,不发生的反应类型是( )

| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 还原反应 |

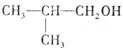 .
.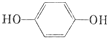 .
.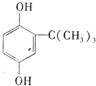 .
.