题目内容
14.某研究小组欲探究SO2的化学性质,设计了如图1实验方案.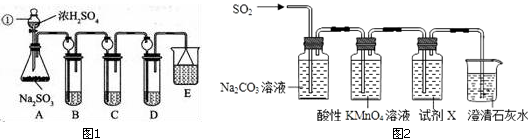
(1)指出仪器①的名称:分液漏斗.
(2)检查A装置的气密性的方法是关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好.
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为硫化氢水溶液.
(4)装置C中盛装溴水用以检验SO2的还原性,则C中反应的离子方程式为SO2+Br2+2H2O=SO42-+4H++2Br-.
(5)用如图2装置验证H2SO3比H2CO3酸性强.
①试剂X是品红溶液,其作用是检验SO2是否除尽.
②当观察到品红溶液不褪色,澄清石灰水变浑浊,即证明H2SO3比H2CO3酸性强.
分析 (1)依据仪器形状说出其名称;
(2)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(3)二氧化硫具有氧化性能够氧化硫化氢生成硫沉淀;
(4)二氧化硫具有还原性能够与溴水反应生成氢溴酸和硫酸;
(5)二氧化硫、二氧化碳都能够使澄清石灰水变浑浊,所以要检验二氧化碳,应先排除二氧化硫的干扰,可用酸性高锰酸钾除去二氧化硫,用品红溶液检验二氧化硫是否除尽,再通过澄清石灰水,若品红溶液不褪色,澄清石灰水变浑浊,则证明二氧化碳存在.
解答 解:(1)图中仪器①为:分液漏斗,故答案为:分液漏斗;
(2)检查A装置的气密性的方法是:关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好;
故答案为:关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好;
(3)二氧化硫具有氧化性能够氧化硫化氢生成硫沉淀,所以B中所盛试剂可以为硫化氢水溶液,故答案为:硫化氢水溶液;
(4)二氧化硫具有还原性能够与溴水反应生成氢溴酸和硫酸,离子方程式:SO2+Br2+2H2O=SO42-+4H++2Br-,故答案为:还原;SO2+Br2+2H2O=SO42-+4H++2Br-;
(5)二氧化硫、二氧化碳都能够使澄清石灰水变浑浊,所以要检验二氧化碳,应先排除二氧化硫的干扰,可用酸性高锰酸钾除去二氧化硫,用品红溶液检验二氧化硫是否除尽,再通过澄清石灰水,若品红溶液不褪色,澄清石灰水变浑浊,则证明二氧化碳存在,即可证明:明H2SO3比H2CO3酸性强;
故答案为:①品红溶液;检验SO2是否除尽;②品红溶液不褪色,澄清石灰水变浑浊.
点评 本题为实验题,考查了二氧化硫的检验及性质,明确二氧化硫性质是解题关键,注意实验设计严密性,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 乙醇能够使蛋白质变性,75%(体积分数)的乙醇溶液可用于医疗消毒 | |
| B. | 乙二醇的水溶液凝固点很低,可用作汽车发动机的抗冻剂 | |
| C. | 光照时乙烷与氯气能发生取代反应,工业上常用该反应生产氯乙烷 | |
| D. | 乙酸( CH3COOH)与硬脂酸(C17H35COOH)互为同系物 |
| A. | 反应体系的温度改变 | |
| B. | 反应混合物中各组分的百分含量改变 | |
| C. | 正、逆反应速率改变 | |
| D. | 反应物的物质的量改变 |
| A. | 原子半径:Y>X | B. | 最高价氧化物的水化物的酸性:R>W | ||
| C. | 气态氢化物的稳定性:X>W | D. | 单质与水(或酸)反应的剧烈程度:Z>Y |
| A. | CH4的比例模型: | B. | 乙醇的结构简式C2H6O | ||
| C. | 乙炔分子式:HC≡CH | D. | 丙酸的键线式: |
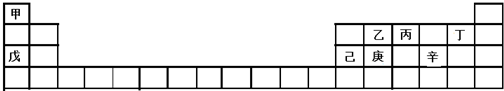
| A. | 甲、戊、己的单质都是金属 | |
| B. | 乙、丙、丁的氢化物稳定性依次增强 | |
| C. | 庚的氧化物不能和丁的氢化物反应 | |
| D. | 己的氧化物能分别与戊和辛的最高价氧化物的水化物反应 |
| A. | “青篙一握,以水二升渍,绞取汁”,该过程是对青篙素的提取,属于化学变化 | |
| B. | 向漂白粉溶液中滴加少量醋酸,漂白速率会加快 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 |
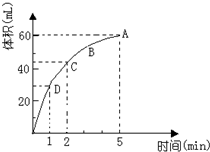 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放