题目内容
能正确表示下列反应的离子方程式是( )
| A、醋酸钠的水解反应:CH3COO-+H3O+?CH3COOH+H2O |
| B、稀H2SO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、Fe(OH)3沉淀中加入足量HI:Fe(OH)3+3H+=Fe3++3H2O |
| D、AlCl3溶液中与过量氨水混合:Al3++3NH3?H2O=3NH4++Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.醋酸根水解生成醋酸和氢氧根离子;
B.离子个数不符合物质的配比;
C.三价铁离子能够氧化碘离子;
D.AlCl3溶液中与过量氨水混合,反应生成氢氧化铝和氯化铵.
B.离子个数不符合物质的配比;
C.三价铁离子能够氧化碘离子;
D.AlCl3溶液中与过量氨水混合,反应生成氢氧化铝和氯化铵.
解答:
解:A.醋酸钠的水解反应,离子方程式:CH3COO-+H2O?CH3COOH+OH-,故A错误;
B.稀H2SO4与足量Ba(OH)2溶液混合,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.在Fe(OH)3中加入HI溶液:2Fe(OH)3+2I-+6H+═2Fe2++6H2O+I2,故C错误;
D.AlCl3溶液中与过量氨水混合,离子方程式:Al3++3NH3?H2O=3NH4++Al(OH)3↓,故D正确;
故选:D.
B.稀H2SO4与足量Ba(OH)2溶液混合,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.在Fe(OH)3中加入HI溶液:2Fe(OH)3+2I-+6H+═2Fe2++6H2O+I2,故C错误;
D.AlCl3溶液中与过量氨水混合,离子方程式:Al3++3NH3?H2O=3NH4++Al(OH)3↓,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,题目难度不大,熟悉物质的性质明确反应的实质是解题关键,注意反应物用量对反应的影响,选项CD为易错选项.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、由水电离产生c (H+)=10-10mol/L的溶液:NH4+、AlO2-、Ca2+、S2- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:K+、SO32-、S2-、SO42- |
用NA表示阿伏加德罗常数的值,下列说法正确的是l相对原子质量:C-12N-14O-16( )
| A、0.1mol/L稀盐酸中,Cl-数为0.1NA |
| B、2.24 L NH3中含N-H键数目为0.3NA |
| C、2.8g N2和2.8g CO所含分子数均为0.1NA |
| D、0.lmol H2O2完全分解转移的电子数为0.2NA |
对于反应4HCl(浓)+MnO2
Cl2↑+MnCl2+2H2O,下列说法中不正确的是( )
| ||
| A、该反应是氧化还原反应 |
| B、MnO2是氧化剂 |
| C、HCl是还原剂 |
| D、HCl被还原 |
中学化学课本中有大量的数据资料.下面是某学生对数据的利用.其中不正确的是( )
| A、利用相对分子质量大小可以判断某些物质的熔沸点高低 |
| B、利用密度数据可判断液体物质挥发性的大小 |
| C、利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D、利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
下列物质的化学用语不正确的是( )
A、甲烷分子的球棍模型: |
B、乙烯的比例模型为: |
| C、乙醛的分子式:CH3CHO |
| D、乙酸乙酯的最简式:C2H |
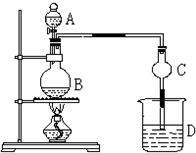 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题: