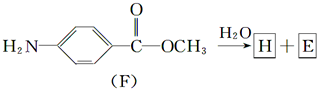题目内容
现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度(待测的NaOH溶液放在锥形瓶中),请填写下列空白:
(1)如图1是酸式滴定管中液面在滴定前后的读数:c (NaOH)= ;
若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会 (偏高、偏低).
(2)若用甲基橙作指示剂,当锥形瓶中溶液的颜色 ,判断已达到滴定终点,滴定终点时锥形瓶内溶液的pH约为 .
(3)如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线b是用 溶液滴定 溶液;盐酸的物质的量浓度为 mol/L.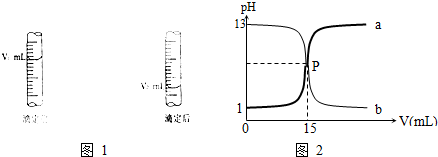
(1)如图1是酸式滴定管中液面在滴定前后的读数:c (NaOH)=
若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会
(2)若用甲基橙作指示剂,当锥形瓶中溶液的颜色
(3)如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线b是用

考点:中和滴定
专题:实验题
分析:(1)据c(待测)=
求算;首先分析错误操作对V(标准)的影响,再据c(待测)=
分析误差;
(2)甲基橙在碱性溶液中显黄色,当用盐酸滴定氢氧化钠达到滴定终点时,溶液颜色有黄色变为橙色;甲基橙的变色范围是 小于3.1是红色 3.1-4.4橙色 大于4.4是黄色,所以滴定终点时锥形瓶内溶液的pH约为4.4;
(3)曲线b滴定前pH为13,为NaOH溶液,是用盐酸滴定氢氧化钠溶液;盐酸滴定前pH为1,所以其浓度为0.1mol/L.
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
(2)甲基橙在碱性溶液中显黄色,当用盐酸滴定氢氧化钠达到滴定终点时,溶液颜色有黄色变为橙色;甲基橙的变色范围是 小于3.1是红色 3.1-4.4橙色 大于4.4是黄色,所以滴定终点时锥形瓶内溶液的pH约为4.4;
(3)曲线b滴定前pH为13,为NaOH溶液,是用盐酸滴定氢氧化钠溶液;盐酸滴定前pH为1,所以其浓度为0.1mol/L.
解答:
解:(1)c(NaOH)=
=
mol/L;在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,导致V(HCl)偏大,据c(NaOH)=
分析,c(NaOH)偏高,故答案为:
mol/L;偏高;
(2)甲基橙在碱性溶液中显黄色,当用盐酸滴定氢氧化钠达到滴定终点时,溶液颜色有黄色变为橙色;甲基橙的变色范围是 小于3.1是红色 3.1-4.4橙色 大于4.4是黄色,所以滴定终点时锥形瓶内溶液的pH约为4.4,故答案为:黄色变为橙色;4.4;
(3)曲线b滴定前pH为13,为NaOH溶液,是用盐酸滴定氢氧化钠溶液;盐酸滴定前pH为1,所以其浓度为0.1mol/L,故答案为:盐酸;氢氧化钠;0.1.
| c(HCl)×V(HCl) |
| V(NaOH) |
| (V2-V1)×a |
| V |
| c(HCl)×V(HCl) |
| V(NaOH) |
| (V2-V1)×a |
| V |
(2)甲基橙在碱性溶液中显黄色,当用盐酸滴定氢氧化钠达到滴定终点时,溶液颜色有黄色变为橙色;甲基橙的变色范围是 小于3.1是红色 3.1-4.4橙色 大于4.4是黄色,所以滴定终点时锥形瓶内溶液的pH约为4.4,故答案为:黄色变为橙色;4.4;
(3)曲线b滴定前pH为13,为NaOH溶液,是用盐酸滴定氢氧化钠溶液;盐酸滴定前pH为1,所以其浓度为0.1mol/L,故答案为:盐酸;氢氧化钠;0.1.
点评:本题考查了中和滴定的计算、误差分析和据图象分析中和滴定过程,注意滴定前溶液的pH,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列操作错误的是( )
| A、Cu中混有CuO,可以通过加入足量盐酸溶液,再过滤、洗涤、干燥可得到洁净的Cu |
| B、把1 mL饱和FeCl3溶液逐滴加入到20 mL的沸水中,边加边搅拌,加热到沸腾即可得Fe(OH)3胶体 |
| C、蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |


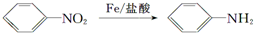 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)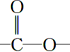 结构.
结构.