题目内容
某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度
①取废水样10.0mL于锥形瓶,加入10.0mL KI溶液(足量),滴入指示剂2-3滴.
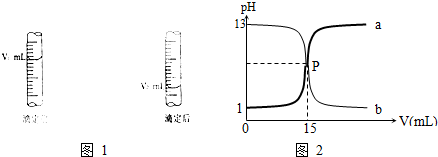
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01mol?L-1的Na2S2O3标准液,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6.
试回答下列问题:
(1)步骤①加入的指示剂是 .
(2)步骤①反应的离子方程式是
(3)步骤 ②应使用 式滴定管.
(4)步聚 ③当待测液由 色变为 色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为 .
(5)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”),
(6)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”).
①取废水样10.0mL于锥形瓶,加入10.0mL KI溶液(足量),滴入指示剂2-3滴.
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01mol?L-1的Na2S2O3标准液,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6.
试回答下列问题:
(1)步骤①加入的指示剂是
(2)步骤①反应的离子方程式是
(3)步骤 ②应使用
(4)步聚 ③当待测液由
(5)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度
(6)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度
考点:中和滴定
专题:实验题
分析:(1)氯气氧化碘离子生成碘单质,碘与淀粉变蓝色;
(2)氯气氧化碘离子生成碘单质;
(3)Na2S2O3标准液显碱性;
(4)碘与淀粉变蓝色,当滴入Na2S2O3标准液将碘单质完全还原,溶液由蓝色变为无色,即达到滴定终点;先据c(I2)=
×
求出n(I2),再据Cl2+2 I-=I2+2 Cl-求n(Cl2);
(5)盛装标准液的滴定管未用标准液润洗,导致标准液浓度偏低,所用标准液体积偏大,据c(I2)=
×
分析,c(I2)偏大则Cl2的物质的量浓度会偏大;
(6)滴定前仰视,滴定后又俯视,导致标准液体积偏小,据c(I2)=
×
分析,c(I2)偏小则Cl2的物质的量浓度会偏小.
(2)氯气氧化碘离子生成碘单质;
(3)Na2S2O3标准液显碱性;
(4)碘与淀粉变蓝色,当滴入Na2S2O3标准液将碘单质完全还原,溶液由蓝色变为无色,即达到滴定终点;先据c(I2)=
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
(5)盛装标准液的滴定管未用标准液润洗,导致标准液浓度偏低,所用标准液体积偏大,据c(I2)=
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
(6)滴定前仰视,滴定后又俯视,导致标准液体积偏小,据c(I2)=
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
解答:
解:(1)步骤①加入淀粉溶液作指示剂,故答案为:淀粉溶液;
(2)氯气氧化碘离子生成碘单质,离离子方程式为:Cl2+2 I-=I2+2 Cl-,故答案为:Cl2+2 I-=I2+2 Cl-;
(3)Na2S2O3标准液显碱性,应该使用碱式滴定管,故答案为:碱;
(4)碘与淀粉变蓝色,当滴入Na2S2O3标准液将碘单质完全还原,溶液由蓝色变为无色,即达到滴定终点;c(I2)=
×
=
=0.005mol/L,n(Cl2)=n(I2)=0.005mol/L×0.020L=0.0001mol,10mL废水中c(Cl2)=
=0.01mol/L,
故答案为:蓝;无;0.01mol/L;
(5)盛装标准液的滴定管未用标准液润洗,导致标准液浓度偏低,所用标准液体积偏大,据c(I2)=
×
分析,c(I2)偏大,c(I2)偏大则Cl2的物质的量浓度会偏大,故答案为:偏大;
(6)滴定前仰视,滴定后又俯视,导致标准液体积偏小,据c(I2)=
×
分析,c(I2)偏小,c(I2)偏小则Cl2的物质的量浓度会偏小,故答案为:偏小.
(2)氯气氧化碘离子生成碘单质,离离子方程式为:Cl2+2 I-=I2+2 Cl-,故答案为:Cl2+2 I-=I2+2 Cl-;
(3)Na2S2O3标准液显碱性,应该使用碱式滴定管,故答案为:碱;
(4)碘与淀粉变蓝色,当滴入Na2S2O3标准液将碘单质完全还原,溶液由蓝色变为无色,即达到滴定终点;c(I2)=
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
| 0.01mol/L×0.020L |
| 2×0.020L |
| 0.0001mol |
| 0.01L |
故答案为:蓝;无;0.01mol/L;
(5)盛装标准液的滴定管未用标准液润洗,导致标准液浓度偏低,所用标准液体积偏大,据c(I2)=
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
(6)滴定前仰视,滴定后又俯视,导致标准液体积偏小,据c(I2)=
| 1 |
| 2 |
| c(Na2S2O3)×V(Na2S2O3) |
| V(I2) |
点评:本题考查了氧化还原滴定中指示剂的使用、滴定终点的判断、滴定管的使用、滴定计算,题目难度中等.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,56g乙烯和丙烯的混合气中含有的碳原子数为4NA |
| B、156g Na2O2固体与足量的二氧化碳反应时,转移的电子数为4NA |
| C、将1.06克Na2CO3固体溶于水,溶液中含CO32-数目为0.01NA |
| D、标准状况下,向溶有2.24LSO2的水溶液中,通入3.36LCl2,转移电子数目0.2NA |
同体积、同物质的量浓度的几种可溶性盐的溶液中,一定含有相同的( )
| A、溶质的物质的量 |
| B、溶质的质量 |
| C、酸根离子数 |
| D、金属离子数 |
将植物油和水分离的方法为( )
| A、蒸发 | B、蒸馏 | C、过滤 | D、分液 |
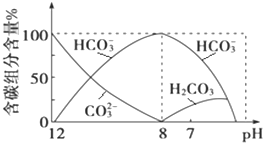 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.