题目内容
在一定温度下,0L密闭容器中加入5molSO2,2.5molO2,经10min后反应达平衡时有3molSO2发生了反应.试计算:(1)O2的转化率为 (2)用SO2表示该反应的反应速率为 (3)用O2表示该反应的反应速率为 (4)平衡时体系中SO3的百分含量(体积分数,保留一位小数)为 .
考点:化学平衡的计算
专题:化学平衡专题
分析:根据化学平衡三段式计算出平衡时各组分浓度,
(1)利用转化率=
×100%计算;
(2)依据反应速率v=
计算;
(3)依据反应速率v=
计算;
(4)依据平衡时体系中SO3的百分含量=
×100%计算.
(1)利用转化率=
| 消耗量 |
| 起始量 |
(2)依据反应速率v=
| △c |
| △t |
(3)依据反应速率v=
| △c |
| △t |
(4)依据平衡时体系中SO3的百分含量=
| SO3的量 |
| 气体总量 |
解答:
解:10L密闭容器中加入5molSO2、2.5molO2,c(SO2)=0.5mol/L,c(O2)=0.25mol/L,经10min后反应达平衡时反应的SO2的浓度为0.3mol/L,
则 2SO2 +O2 ?2SO3
起始浓度(mol/L) 0.5 0.25 0
变化浓度(mol/L) 0.3 0.15 0.3
平衡浓度(mol/L) 0.2 0.1 0.3
(1)10min内O2的转化率为
×100%=60%,故答案为:60%;
(2)用SO2表示该反应的反应速率为
=0.03mol/(L?min),故答案为:0.03mol/(L?min);
(3)O2表示该反应的反应速率为
=0.015mol/(L?min),故答案为:0.015mol/(L?min);
(4)平衡时体系中SO3的百分含量为
×100%=33.3%,故答案为:33.3%.
则 2SO2 +O2 ?2SO3
起始浓度(mol/L) 0.5 0.25 0
变化浓度(mol/L) 0.3 0.15 0.3
平衡浓度(mol/L) 0.2 0.1 0.3
(1)10min内O2的转化率为
| 0.15mol/L |
| 0.25mol/L |
(2)用SO2表示该反应的反应速率为
| 0.3mol/L |
| 10min |
(3)O2表示该反应的反应速率为
| 0.15mol/L |
| 10min |
(4)平衡时体系中SO3的百分含量为
| 0.2 |
| 0.2+0.1+0.3 |
点评:本题考查化学平衡的计算,明确化学平衡的三段式计算格式是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
下列Cl-的物质的量浓度与100mL 0.5mol?L-1 NaCl溶液相同的是( )
| A、100mL 0.5mol?L-1 MgCl2溶液 |
| B、200mL 0.25mol?L-1 AlCl3溶液 |
| C、50mL 1mol?L-1 NaCl溶液 |
| D、25mL 0.5mol?L-1 HCl溶液 |
同体积、同物质的量浓度的几种可溶性盐的溶液中,一定含有相同的( )
| A、溶质的物质的量 |
| B、溶质的质量 |
| C、酸根离子数 |
| D、金属离子数 |
下列物质的名称、俗名与化学式完全对应的是( )
| A、氢氧化钙 熟石灰 CaO |
| B、碳酸钙 生石灰 CaCO3 |
| C、氯化钠 食盐 NaCl |
| D、汞 水银 Ag |
阿司匹林又名乙酰水杨酸,推断它不应具有的性质( )

| A、与NaOH溶液反应 |
| B、与金属钠反应 |
| C、与乙酸发生酯化反应 |
| D、与乙醇发生酯化反应 |
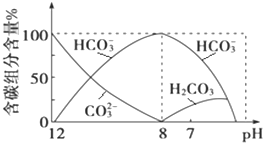 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.