题目内容
钢铁在干燥的空气中不易生锈,但在潮湿的空气中通过原电池反应却易生锈.右图是钢铁在空气中腐蚀的一种形式的示意图.请回答下列问题: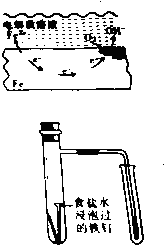
(1)右图所示的钢铁腐蚀称为 腐蚀.
(2)腐蚀过程中,电池的正极反应是 ,总反应为 ;
(3)研究性学习小组的同学用右图所示的装置模拟上述过程,几分钟后观察导管中水柱的变化,现象为 ,简述原因 .
(4)根据上述原理,请说出一种防止钢铁腐蚀的方法 .

(1)右图所示的钢铁腐蚀称为
(2)腐蚀过程中,电池的正极反应是
(3)研究性学习小组的同学用右图所示的装置模拟上述过程,几分钟后观察导管中水柱的变化,现象为
(4)根据上述原理,请说出一种防止钢铁腐蚀的方法
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:(1)根据图知,Fe失电子发生氧化反应,氧气得电子发生还原反应,所以发生吸氧腐蚀;
(2)正极上氧气得电子和水反应生成氢氧根离子,负极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁;
(3)铁发生吸氧腐蚀导致具支试管中气体压强减小,导致右边试管导管中水面上升;
(4)铁、氧气和电解质溶液构成原电池,铁作负极易被腐蚀,只要隔绝空气或电解质溶液就能防止钢铁腐蚀.
(2)正极上氧气得电子和水反应生成氢氧根离子,负极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁;
(3)铁发生吸氧腐蚀导致具支试管中气体压强减小,导致右边试管导管中水面上升;
(4)铁、氧气和电解质溶液构成原电池,铁作负极易被腐蚀,只要隔绝空气或电解质溶液就能防止钢铁腐蚀.
解答:
(1)根据图知,Fe失电子发生氧化反应,氧气得电子发生还原反应生成氢氧根离子,所以发生吸氧腐蚀,故答案为:吸氧;
(2)正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,负极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,电池反应式为2Fe+2H2O+O2═2Fe(OH)2,
故答案为:O2+2H2O+4e-=4OH-;2Fe+2H2O+O2═2Fe(OH)2;
(3)铁发生吸氧腐蚀导致具支试管中气体压强减小,大气压不变,导致右边试管导管中水面上升,
故答案为:右边试管导管中水面上升;铁发生吸氧腐蚀导致具支试管中气体压强减小,大气压不变,导致右边试管导管中水面上升;
(4)铁、氧气和电解质溶液构成原电池,铁作负极易被腐蚀,只要隔绝空气或电解质溶液就能防止钢铁腐蚀,如在钢铁上涂油等,故答案为:涂油.
(2)正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,负极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,电池反应式为2Fe+2H2O+O2═2Fe(OH)2,
故答案为:O2+2H2O+4e-=4OH-;2Fe+2H2O+O2═2Fe(OH)2;
(3)铁发生吸氧腐蚀导致具支试管中气体压强减小,大气压不变,导致右边试管导管中水面上升,
故答案为:右边试管导管中水面上升;铁发生吸氧腐蚀导致具支试管中气体压强减小,大气压不变,导致右边试管导管中水面上升;
(4)铁、氧气和电解质溶液构成原电池,铁作负极易被腐蚀,只要隔绝空气或电解质溶液就能防止钢铁腐蚀,如在钢铁上涂油等,故答案为:涂油.
点评:本题考查金属的电化学腐蚀与防护,明确原电池原理是解本题关键,知道钢铁发生吸氧腐蚀和析氢腐蚀的区别,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
同体积、同物质的量浓度的几种可溶性盐的溶液中,一定含有相同的( )
| A、溶质的物质的量 |
| B、溶质的质量 |
| C、酸根离子数 |
| D、金属离子数 |
电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣.下列关于电解质溶液的叙述中正确的是( )
| A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B、常温下,1 mol?L-1的CH3COOH溶液与1 mol?L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、将AlCl3溶液加热蒸干并灼烧后剩余固体为Al2O3 |
| D、常温下,某溶液中由水电离出的c(H+)=10-5 mol?L-1,则此溶液可能是盐酸 |
阿司匹林又名乙酰水杨酸,推断它不应具有的性质( )

| A、与NaOH溶液反应 |
| B、与金属钠反应 |
| C、与乙酸发生酯化反应 |
| D、与乙醇发生酯化反应 |
将植物油和水分离的方法为( )
| A、蒸发 | B、蒸馏 | C、过滤 | D、分液 |