题目内容
9.关于离子键、共价键等化学键的下列叙述中正确的( )| A. | 在单质中一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学键断裂一定伴随着化学变化 |
分析 A.阴阳离子间的静电作用为离子键;
B.共价化合物中可能含有非极性键;
C.离子化合物一定含有离子键,可能含有共价键;
D.电解质溶于水发生电离,化学键断裂.
解答 解:A.阴阳离子间的静电作用为离子键,离子键只存在于离子化合物中,故A正确;
B.共价化合物中可能含有非极性键,如双氧水中氧原子和氧原子之间存在非极性键,故B错误;
C.离子化合物一定含有离子键,可能含有共价键,如氢氧化钠是离子化合物,但氢氧化钠含有共价键,故C错误;
D.电解质溶于水发生电离,化学键断裂,属于物理变化,故D错误.
故选A.
点评 本题考查了化学键类型和化合物类型的关系,难度不大,注意:共价化合物中可能含有金属元素,如氯化铝含有金属元素,但氯化铝是共价化合物

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是( )
| A. | 纯锌与稀硫酸反应 | B. | 纯锌和浓硫酸反应 | ||
| C. | 纯锌与稀盐酸反应 | D. | 粗锌(含铅、铜杂质)与稀硫酸反应 |
20.量取20.00mL0.03mol/LX溶液于锥形瓶中,用滴定管逐滴滴入0.03mol/L的Y溶液,溶液的pH变化曲线如图所示,下列说法正确的是( )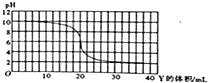

| A. | X和Y可能是KOH和CH3COOH | |
| B. | X和Y可能是NH3•H2O和HCl | |
| C. | X和Y恰好中和时,溶液呈中性 | |
| D. | X和Y恰好完全反应时的溶液中由水电离出的c(H+)=1×10-8mol/L |
17.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、 -2 | +2 | -2 | +1 |
| A. | K、L、M三元素的金属性逐渐增强 | |
| B. | T元素的化合价除了-2价,只有0价 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物为淡黄色 |
4.对于A2+3B2=2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(B2)=0.8 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.6 mol•L-1•min-1 |
14.下列物质属于电解质的是( )
| A. | 蔗糖 | B. | 玻璃 | C. | 纯碱 | D. | 铁 |
1.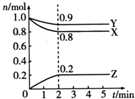 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )| A. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| B. | 反应开始到2min,X的物质的量浓度减少了0.4 mol•L-1 | |
| C. | 反应开始到2min,用Y表示的反应速率为0.1mol•L-1•min-1 | |
| D. | 反应到2min时,Z的物质的量浓度为0.2mol•L-1 |
1.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在这些元素中,化学性质最不活泼的是Ne,元素原子半径最小的是H,被称为“国防金属”的是Mg,被称为“生命元素”的是P,单质氧化性最强的元素是F.
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是${\;}_{6}^{14}$C.
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是KOH.酸性最强的化合物的化学式是HClO4.
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式NH3+HNO3=NH4NO3.
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ |
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是${\;}_{6}^{14}$C.
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是KOH.酸性最强的化合物的化学式是HClO4.
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式NH3+HNO3=NH4NO3.
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.