题目内容
4.下列叙述中正确的是( )| A. | 元素性质呈现周期性的变化的根本原因是核外电子排布呈周期性变化 | |
| B. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 甲烷化学性质稳定,点燃前不必验纯 |
分析 A、原子的电子排布决定元素的性质;
B、阴阳离子间通过静电作用,包括引力和斥力;
C、有些含碳的化合物的性质与无机物相似;
D、易燃气体点燃前要验纯,以免发生爆炸;
解答 解:A、原子的电子排布决定元素的性质,即元素的性质呈现周期性变化的根本原因是核外电子排布的周期性变化,故A正确;
B、阴阳离子间通过静电作用,包括引力和斥力,故B错误;
C、有些含碳的化合物的性质与无机物相似,如二氧化碳是无机物,故C错误;
D、甲烷为可燃性气体,点燃前需检验纯度,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的发现及元素周期律为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.现有盐酸和硫酸混合溶液200mL,其中c(Cl-)=0.6mol•L-1.现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生4.66g白色沉淀,往另一份中投入足量铁片,放出标准状况下VL气体,下列判断正确的是( )
| A. | V=1.12 | B. | 原混合酸中c(H2SO4)=0.1mol•L-1 | ||
| C. | 原混合酸中c(H+)=2mol•L-1 | D. | 另一份中消耗铁5.6g |
15. 分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
 分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
12.可逆反应达到化学平衡时,下列叙述正确的是( )
| A. | 反应停止了 | B. | 正逆反应速率为零 | ||
| C. | 反应物与生成物的浓度一定相等 | D. | 正逆反应速率相等 |
19.关于如图所示装置的叙述中正确的是( )
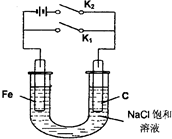

| A. | 若仅闭合K2,铁极的电极反应式:Fe-2e=Fe2+ | |
| B. | 若仅闭合K2,炭极上发生还原反应 | |
| C. | 若仅闭合K1,电子由炭极沿导线流向铁极 | |
| D. | 若仅闭合K1,炭极的电极反应式:2H2O+O2+4e=4OH- |
9. 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 该电池的内电路中,阳离子向负极迁移 | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
16.下列有关钠的叙述中错误的是( )
| A. | 电解法冶炼金属钠时,钠在阳极析出 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| D. | 钠的质地软,可用小刀切割 |
13.进行下列实验时,仪器和药品选用都正确的是( )
| A. | 用饱和食盐水和电石在启普发生器中制乙炔 | |
| B. | 用氢氧化钠溶液洗去混在乙酸乙酯中的乙酸 | |
| C. | 把醋酸钠晶体与碱石灰混和,放在试管中加热制甲烷 | |
| D. | 苯和液溴混合于烧瓶中,加入铁粉制溴苯 |