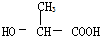题目内容
8.下列溶液中溶质的质量百分比浓度最大的是( )| A. | 福尔马林 | B. | 食醋 | C. | 生理盐水 | D. | 医用酒精 |
分析 A、福尔马林是具有防腐、消毒和漂白的功能,溶质是甲醛;
B、食醋中所含醋酸的量也不同,一般大构在5~8%之间,食醋的酸味强度的高低主要是其中所含醋酸量的大小所决定;
C、生理盐水就是0.9%的氯化钠水溶液,因为它的渗透压值和正常人的血浆、组织液都是大致一样的,所以可以用作补液以及其他医疗用途,也常用作体外培养活组织、细胞,是人体细胞所处的液体环境浓度;
D、医用酒精的成份主要是乙醇.日常生活中,常见一些人用医用酒精来擦洗伤口,以达到灭菌消毒的目的.
解答 解:A、福尔马林是甲醛的水溶液,溶质的质量分数为甲醛含量为35%至40%(一般是37%)的水溶液;
B、食醋是醋酸的水溶液,溶质的质量分数为一般大构在5~8%之间;
C、生理盐水是氯化钠的水溶液,溶质质量分数为0.9%;
D、医用消毒酒精是乙醇的水溶液,体积分数是75%的酒精用于消毒,其质量分数是67.9%.
所以溶质的质量分数由大到小的顺序是DABC.
故选D.
点评 本题考查了常见溶液的成分和浓度,各种溶液的主要作用,主要是各种溶液的溶质质量分数的记忆和理解.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
19.关于如图所示装置的叙述中正确的是( )
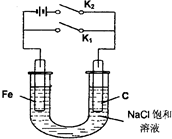

| A. | 若仅闭合K2,铁极的电极反应式:Fe-2e=Fe2+ | |
| B. | 若仅闭合K2,炭极上发生还原反应 | |
| C. | 若仅闭合K1,电子由炭极沿导线流向铁极 | |
| D. | 若仅闭合K1,炭极的电极反应式:2H2O+O2+4e=4OH- |
16.下列有关钠的叙述中错误的是( )
| A. | 电解法冶炼金属钠时,钠在阳极析出 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| D. | 钠的质地软,可用小刀切割 |
3.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.再经过一系列操作,分离得到产品.
(1)步骤Ⅰ中过滤所得滤渣主要成分为:SiO2,H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度均为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②步骤Ⅳ中加入MnSO4的目的是:除去过量的MnO4-.
(5)步骤Ⅴ中“一系列操作”是蒸发浓缩、冷却结晶.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.再经过一系列操作,分离得到产品.
(1)步骤Ⅰ中过滤所得滤渣主要成分为:SiO2,H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②步骤Ⅳ中加入MnSO4的目的是:除去过量的MnO4-.
(5)步骤Ⅴ中“一系列操作”是蒸发浓缩、冷却结晶.
13.进行下列实验时,仪器和药品选用都正确的是( )
| A. | 用饱和食盐水和电石在启普发生器中制乙炔 | |
| B. | 用氢氧化钠溶液洗去混在乙酸乙酯中的乙酸 | |
| C. | 把醋酸钠晶体与碱石灰混和,放在试管中加热制甲烷 | |
| D. | 苯和液溴混合于烧瓶中,加入铁粉制溴苯 |
20.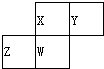 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值不可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
18.已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学兴趣研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8℃,沸点是44.8℃.
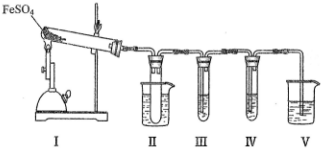
(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
(4)装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是NaOH溶液.

(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入BaCl2溶液 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |