题目内容
1.下列表示物质结构的化学用语正确的是( )| A. | Cl-离子的结构示意图: | B. | HF的电子式: | ||
| C. | 8个中子的碳原子的核素符号:12C | D. | CO2的结构式:O=C=O |
分析 A.氯离子的核电荷数为17,不是18;
B.氟化氢为共价化合物,分子中不存在阴阳离子;
C.8个中子的碳原子的质量数为14,不是12;
D.二氧化碳分子中含有2个碳氧双键,为直线型结构.
解答 解:A.Cl-是由氯原子得一个电子形成的,核内有17个质子,核外有18个电子,正确的两种结构示意图为: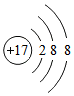 ,故A错误;
,故A错误;
B.HF为共价化合物,电子式中不存在阴阳离子,其正确的电子式为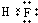 ,故B错误;
,故B错误;
C.8个中子的碳原子的质量数为14,该核素正确的表示方法为:14C,故C错误;
D.二氧化碳为直线型结构,分子中含有两个碳氧双键,CO2的结构式为:O=C=O,故D正确;
故选D.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、元素符号、离子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
7.下列转化需要加入氧化剂才能实现的是( )
| A. | H2S SO2 | B. | H2SO4 SO2 | C. | SO2 SO32- | D. | SO32- SO2 |
9.甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol•L-1.如果在甲瓶中加入少量的CaCO3晶体(m mol),在乙瓶中加入少量CaSO3晶体(m mol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )
| A. | 甲=乙>丙 | B. | 丙>甲=乙 | C. | 甲>乙>丙 | D. | 甲>丙>乙 |
16.已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
6.玻尔认为原子核外电子离核越近能量越低.那么,电子从离核无穷远处跃迁到氢离子(H+)的K层所释放的光子在氢原子的发射光谱中对应( )的光子.
| A. | 波长最长 | B. | 波长最短 | C. | 平均波长 | D. | 中间波长 |
10.下列元素中,金属性最强的是( )
| A. | Na | B. | Mg | C. | Cs | D. | K |