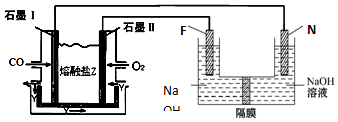
题目内容
9.甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol•L-1.如果在甲瓶中加入少量的CaCO3晶体(m mol),在乙瓶中加入少量CaSO3晶体(m mol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )| A. | 甲=乙>丙 | B. | 丙>甲=乙 | C. | 甲>乙>丙 | D. | 甲>丙>乙 |
分析 HClO的酸性比碳酸弱但比HCO3-的酸性强,加入少量的NaHCO3晶体,可促进氯气与水的反应,生成更多的HClO,HClO可与NaHSO3发生氧化还原反应而导致浓度降低.
解答 解:甲中加入少量的NaHCO3晶体:HClO的酸性比碳酸弱但比HCO3-的酸性强,加入少量的NaHCO3晶体,可促进氯气与水的反应,生成更多的HClO;
乙中加入少量的NaHSO3晶体:HClO可与NaHSO3发生氧化还原反应而导致浓度降低;
丙不变,
则甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系为甲>丙>乙.
故选D.
点评 本题考查氯气的化学性质以及外界条件对氯气与水反应的平衡影响,题目难度不大,本题注意从氯气的性质的角度分析.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
15.设NA表示阿伏加德罗常数的值,下列叙述中对应的值为 NA的是( )
| A. | 30 g由乙酸和乳酸组成的混合物中所含有的O原子数 | |
| B. | Cu和足量的稀硝酸反应产生7.47 L NO气体时转移的电子数 | |
| C. | 0.25 mol丁烷中含有的非极性键数 | |
| D. | 1 mol FeCl3加入沸水制得的胶体中含有胶体粒子数 |
16.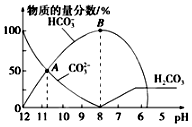 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
14.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
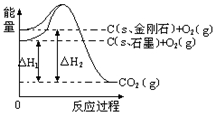

| A. | 石墨和金刚石互为同位素 | |
| B. | 金刚石的总能量比石墨的总能量高1.9 kJ | |
| C. | C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1 | |
| D. | C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1 |
1.下列表示物质结构的化学用语正确的是( )
| A. | Cl-离子的结构示意图: | B. | HF的电子式: | ||
| C. | 8个中子的碳原子的核素符号:12C | D. | CO2的结构式:O=C=O |
18.下列实验现象中,是由发生取代反应而造成的是( )
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,振荡后水层接近无色 | |
| D. | 向新制的氢氧化铜悬浊液中加入乙醛溶液,加热后产生砖红色沉淀 |
19.下列仪器使用正确的是( )
| A. | 在表面皿蒸发浓缩NaCl溶液 | |
| B. | 用带玻璃塞的试剂瓶盛盐酸 | |
| C. | 使用漏斗、滤纸、玻璃棒等进行过滤实验 | |
| D. | 坩埚、试管是能用酒精灯直接加热的仪器 |