题目内容
5.综合如图判断,下列正确的说法是( )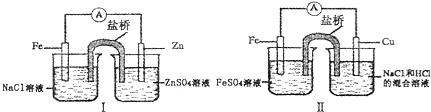
| A. | 装置I和装置II中负极反应均是Fe-2e-═Fe2+ | |
| B. | 装置I和装置II中正极反应均是O2+4e-+2H2O-═4OH- | |
| C. | 装置I和装置II中盐桥中的阳离子均向右侧烧杯移动 | |
| D. | 装置I和装置II中正极均被保护 |
分析 图中装置Ⅰ、Ⅱ都是原电池装置,装置Ⅰ中,Zn为负极,发生氧化反应Zn-2e-═Zn2+,Fe为正极,发生还原反应O2+2H2O+4e-═4OH-.装置Ⅱ中,Fe为负极,发生氧化反应Fe-2e-═Fe2+,Cu为正极,发生还原反应2H++2e-═H2↑,原电池工作时,阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.图中装置Ⅰ、Ⅱ都是原电池,装置Ⅰ中,Zn为负极,发生氧化反应Zn-2e-═Zn2+,装置Ⅱ中,Fe为负极,发生氧化反应Fe-2e-═Fe2+,故A错误;
B.装置Ⅰ中,Fe为正极,发生还原反应O2+2H2O+4e-═4OH-,装置Ⅱ中,Cu为正极,发生还原反应2H++2e-═H2↑,故B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,装置Ⅰ中,Zn为负极,Fe为正极,盐桥中的阳离子向左烧杯移动,装置Ⅱ中,Fe为负极,Cu为正极,盐桥中的阳离子向右侧烧杯移动,故C错误;
D.根据分析,图中装置Ⅰ、Ⅱ正极金属均未反应,被保护,故D正确;
故选D.
点评 本题考查原电池的工作原理,题目难度中等,注意电极的判断和电极方程式的书写,把握原电池的工作原理,装置Ⅰ借助吸氧腐蚀理解,学习中注意相关知识的把握.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,8 g甲烷中含C-H键的数目为4NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA | |
| D. | 标准状况下,16g甲烷分子所含质子数为10NA |
13.下列离子方程式的书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2 O | |
| C. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| D. | 纯碱溶液中通入二氧化碳:CO32-+CO2+H2O=2HCO3- |
20.下列物质属于纯净物的是( )
| A. | 乙烷 | B. | 汽油 | C. | 柴油 | D. | 天然气 |
10.2molFeCl2与1molCl2恰好完全反应,则转移的电子的物质的量为( )
| A. | 4mol | B. | 3mol | C. | 2mol | D. | 1mol |
17.现有含W g碳酸钙和a g二氧化硅的混合物,在高温下反应最终可生成标准状况下的气体体积为( )
| A. | $\frac{a}{60}×22.4$L | B. | $\frac{W}{100}×22.4$L | C. | $\frac{W-a}{40}×22.4$L | D. | 无法计算 |
1.下列装置或操作能达到实验目的是( )
| A. |  量取8.5mL稀硫酸 | B. |  制备Fe(OH)2 | ||
| C. |  防止铁钉生锈 | D. |  用酒精萃取水中的溴 |