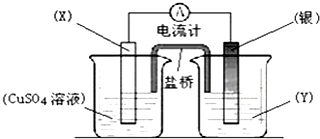
题目内容
6.相同温度下,将等体、积等pH的醋酸和盐酸溶液,分别加入V1 mL、V2mL的水稀释后,测得溶液的pH仍然相同,则下列关系正确的是( )| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | 无法判断 |
分析 醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而盐酸是强电解质,不存在电离平衡,据此进行解答.
解答 解:因为醋酸是弱酸,加水后反应正向进行,醋酸电离度增加,加水后,氢离子浓度在减小的过程中氢离子的物质的量增大,而盐酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,氢离子的物质的量不变,所以要使稀释后两溶液pH值相同,则醋酸的体积比盐酸的体积要大,即:V1>V2,
故选A.
点评 本题考查了弱电解质的电离平衡及其影响,为高频考点,题目难度不大,侧重于学生的分析能力的考查,明确电离平衡及其影响因素为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.在常温常压下,把1molO2和4molN2混合后占有的体积是( )
| A. | 22.4L | B. | 89.6L | C. | 112L | D. | 大于112L |
1. 把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平).下列对该反应的说法不正确的是( )
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平).下列对该反应的说法不正确的是( )
 把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平).下列对该反应的说法不正确的是( )
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平).下列对该反应的说法不正确的是( )| A. | IO4-作氧化剂 | |
| B. | 若有1mol Mn2+参加反应转移5 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 配平后Mn2+、H+的化学计量数分别为2、3 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,8 g甲烷中含C-H键的数目为4NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA | |
| D. | 标准状况下,16g甲烷分子所含质子数为10NA |


 .
. .
.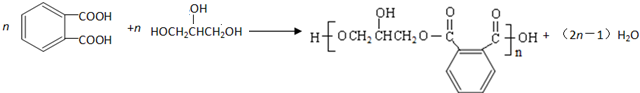 .
. 互为同分异构体的结构简式
互为同分异构体的结构简式 .
.
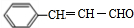
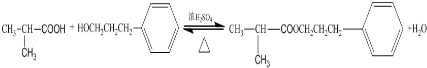
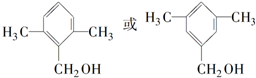 .
.