题目内容
16.下列几种氢键:①O-H…O,②N-H…N,③F-H…F,④O-H…N,其强度由强到弱的排列顺序是( )| A. | ③①②④ | B. | ①②③④ | C. | ③①④② | D. | ①④③② |
分析 电负性大的元素(如O,N,F等)相连的H与电负性大的元素(如O,N,F等)相连才能形成氢键,元素的电负性越大,形成的氢键越强,据此解答.
解答 解:同周期从左到右,元素的电负性逐渐变大,则:电负性:F>O>N,元素的电负性越大,形成的氢键越强,所以故氢键的强度:③F-H…F>①O-H…O>④O-H…N>②N-H…N,
故选C.
点评 本题主要考查氢键的形成条件和强弱的比较,理解氢键形成的条件是解题的关键,注意抓住元素电负性大小进行比较,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列叙述正确的是( )
| A. | 1mol H2O的质量为18g/mol | |
| B. | 2g H2含有的氢原子数为6.02×1023 | |
| C. | 标准状况下,1mol SO3的体积为22.4L | |
| D. | 1L 1mol•L-1 NaOH溶液中含1mol Na+ |
7.NA代表阿伏加德罗常数.下列说法正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA |
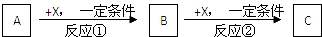
4.塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所含碳原子可能在同一个平面内 | |
| B. | 物质A生成物质B是加成反应,物质B生成物质C是酯化反应 | |
| C. | 物质B具有酚羟基,但不能与浓溴水产生白色沉淀 | |
| D. | 1mol抗氧化剂C能与NaOH溶液反应,最多消耗3 molNaOH |
11.下列化学用语描述正确的是( )
| A. | CO2的电子式? ? ? | B. | Cl-的结构示意图  | ||
| C. | 乙烯的电子式C2H4 | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
1.在铜与稀硝酸的反应中,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为( )
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
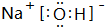 ;
;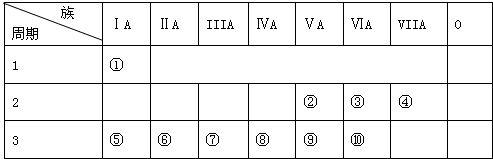
 .
. ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.