题目内容
5.A、B、C、D、E为原子序数依次增大的五种短周期元素,已知A、E同主族,A的原子核内只有一个质子,B原子最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物与C的氢化物反应生成一种盐;A、E二种元素都能与D元素分别形成原子个数比为1:1或1:2的常见化合物,回答下列问题:(1)D在元素周期表中的位置第2周期ⅥA族,BD2的结构式为O=C=O,E的最高价氧化物的水化物电子式为
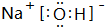 ;
;(2)请用化学式、元素符号、离子符号表示:
①A分别与B、C、D形成的10电子分子的稳定性由强到弱的顺序为:H2O>NH3>CH4.
②D、E分别形成的简单离子半径大小顺序为:O2->Na+.
(3)CD2与A2D反应的化学方程式为:3NO2+H2O=2HNO3+NO.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,A的原子核内只有一个质子,则A为H元素,A、E同主族,二者原子序数相差大于2,故E为Na;B元素的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素的最高价氧化物的水化物与C的氢化物反应生成一种盐,则C为N元素;A、E二种元素都能与D元素分别形成原子个数比为1:1或1:2的常见化合物,则D为O元素.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,A的原子核内只有一个质子,则A为H元素,A、E同主族,二者原子序数相差大于2,故E为Na;B元素的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素的最高价氧化物的水化物与C的氢化物反应生成一种盐,则C为N元素;A、E二种元素都能与D元素分别形成原子个数比为1:1或1:2的常见化合物,则D为O元素.
(1)D为O元素,在元素周期表中的位置 第2周期ⅥA族,CO2的结构式为O=C=O,E的最高价氧化物的水化物为NaOH,电子式为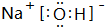 ,
,
故答案为:第2周期ⅥA族;O=C=O;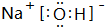 ;
;
(2)①A分别与B、C、D形成的10电子分子分别为CH4、NH3、H2O,非金属性O>N>C,故氢化物稳定性由强到弱的顺序为:H2O>NH3>CH4,
故答案为:H2O>NH3>CH4;
②电子层结构相同的离子,核电荷数越大离子半径越小,故简单离子半径大小顺序为:O2->Na+,
故答案为:O2->Na+;
(3)NO2与H2O反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语元素周期律的考查,是对基础知识的综合考查,有利于基础知识的巩固.

| A. | 75.3g | B. | 2.2mol | C. | 1.2mol | D. | 1mol |
| A. | ③①②④ | B. | ①②③④ | C. | ③①④② | D. | ①④③② |
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3 119.6 kJ•mol-1 | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1 559.8 kJ•mol-1 |
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| A. | 若Z(OH)n为强碱,则W(OH)m也一定为强碱 | |
| B. | 若HnXOm为强酸,则Z的气态氢化物溶于水一定显酸性 | |
| C. | Z可以从W的盐溶液中将W置换出来 | |
| D. | 若Z的最高正价为+3价,则W的氢化物水溶液一定显碱性 |
 ,此炔烃可能有的结构简式有( )
,此炔烃可能有的结构简式有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 8 | B. | 9 | C. | 11 | D. | 14 |