题目内容
6.如表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题: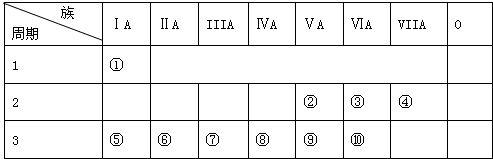
填写下列空白:
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
分析 由元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、F、Na、Mg、Al、Si、P、S元素,
(1)根据元素周期律,同周期从左向右元素非金属性逐渐增加,同主族从上向下元素金属性逐渐增加,所以在上述元素中,非金属性最强的元素是F,其离子带一个单位的负电荷;
(2)②的氢化物为氨气,溶液呈碱性,与少量的氯化铝反应生氢氧化铝;
(3)元素金属性越强,最高价氧化物对应的水化物中碱性越强,所以在上述元素对应的物质中,氢氧化钠的碱性最强,⑦的最高价氧化物对应的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠,据此写离子方程式;
(4)由③⑤⑩三种元素组成、且暴露空气中易变质,说明有还原性,则该物质为亚硫酸钠,能被氧化成硫酸钠.
解答 解:由元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、F、Na、Mg、Al、Si、P、S元素,
(1)根据元素周期律,同周期从左向右元素非金属性逐渐增加,同主族从上向下元素金属性逐渐增加,所以在上述元素中,非金属性最强的元素是F,其离子带一个单位的负电荷,离子结构示意图为 ,
,
故答案为:F; ;
;
(2)②的氢化物为氨气,氨气的电子式为 ,溶液呈碱性,与少量的氯化铝反应生氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
,溶液呈碱性,与少量的氯化铝反应生氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为: ;碱性;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
;碱性;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)元素金属性越强,最高价氧化物对应的水化物中碱性越强,所以在上述元素对应的物质中,氢氧化钠的碱性最强,化学式为NaOH,⑦的最高价氧化物对应的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:NaOH;Al(OH)3+OH-=AlO2-+2H2O;
(4)由③⑤⑩三种元素组成、且暴露空气中易变质,说明有还原性,则该物质为亚硫酸钠,其化学式为Na2SO3,其中含有离子键、共价键,能被氧化成硫酸钠,反应的化学方程式为2Na2SO3+O2=2Na2SO4,
故答案为:离子键、共价键;2Na2SO3+O2=2Na2SO4.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质和元素化合物为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

| A. | ③①②④ | B. | ①②③④ | C. | ③①④② | D. | ①④③② |
| A. | 若Z(OH)n为强碱,则W(OH)m也一定为强碱 | |
| B. | 若HnXOm为强酸,则Z的气态氢化物溶于水一定显酸性 | |
| C. | Z可以从W的盐溶液中将W置换出来 | |
| D. | 若Z的最高正价为+3价,则W的氢化物水溶液一定显碱性 |
 ,此炔烃可能有的结构简式有( )
,此炔烃可能有的结构简式有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O与水反应:O2-+H2O═2OH- | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| A. | 8 | B. | 9 | C. | 11 | D. | 14 |
| X | Y | Z | |
| R | |||
| W | |||
| J |
(1)R原子的电子排布图为
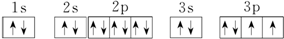 .
.(2)在化合物YZ2中Y的化合价为+2;Y2-与Na+的半径大小为O2->Na+.
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是F>O>N;X与Y的第一电离能:X>Y(填“<”、“>”或“=”),其理由是N原子的p轨道为半充满,能量低较稳定,难失电子.