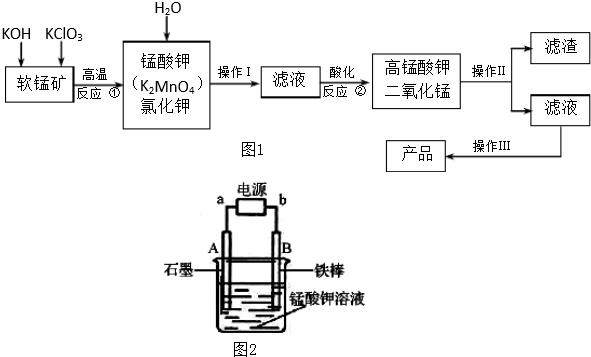
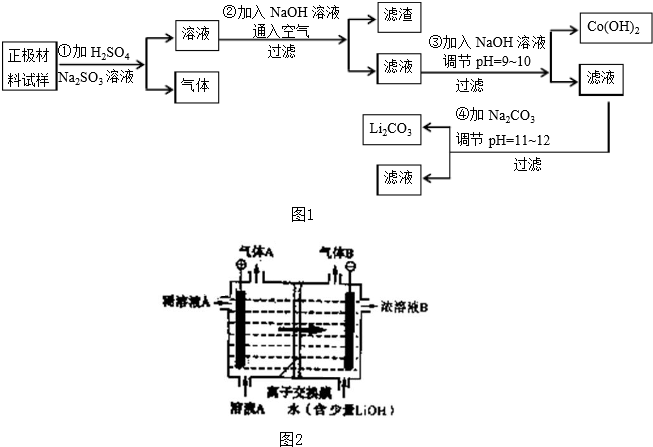
题目内容
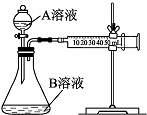 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.(1)该反应的离子方程式为
(2)实验小组通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4) 实验装置如图所示,实验时将
①A:2mL 0.1mol/L H2C2O4溶液 B:4mL 0.01mol/L KMnO4溶液
②A:2mL 0.2mol/L H2C2O4溶液 B:4mL 0.01mol/L KMnO4溶液
③A:2mL 0.2mol/L H2C2O4溶液 B:4mL 0.01mol/L KMnO4溶液和少量MnSO4.
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,据此书写方程式;
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂.
(2)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂.
解答:
解:(1)高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,即2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)盛放A溶液的仪器是分液漏斗,对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂,浓度越大,反应速率越快,使用催化剂可以加快化学反应速率,所得CO2的体积由大到小的顺序是③②①,
故答案为:分液漏斗;浓度、催化剂;③②①.
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)盛放A溶液的仪器是分液漏斗,对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大;对比②③实验可探究催化剂对化学反应速率的影响,③中使用了催化剂,浓度越大,反应速率越快,使用催化剂可以加快化学反应速率,所得CO2的体积由大到小的顺序是③②①,
故答案为:分液漏斗;浓度、催化剂;③②①.
点评:本题考查了影响化学反应速率的因素,难度不大,注意实验方案原理的设计是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ?mol-1,则反应HCl(g)=
2H2(g)+
Cl2(g)的△H为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、+184.6kJ?mol-1 |
| B、+92.3kJ?mol-1 |
| C、-184.6kJ?mol-1 |
| D、-92.3kJ?mol-1 |
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
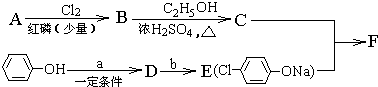
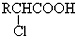 ,
,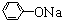 +RCl→
+RCl→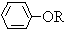 +NaCl
+NaCl