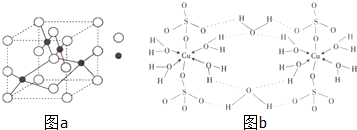
题目内容
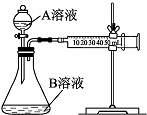
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
写出反应②③的化学方程式:
(2)试管B收集到的产品中,有能使高锰酸钾酸性溶液褪色的物质,该物质的一氯代物有
(3)锥形瓶C中观察到的现象
(4)经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为
考点:性质实验方案的设计,探究石蜡油分解制乙烯及乙烯的化学性质
专题:
分析:(1)电石为碳化钙与水反应生成乙炔;乙炔含有碳碳三键能够加聚生成聚乙炔;
(2)能使酸性高锰酸钾溶液褪色的物质有乙烯、丙烯和甲苯,但是只有甲苯在0℃是液态,依据甲苯中含不同氢原子种数判断一氯代物的种数;
(3)乙烯、丙烯均含有碳碳双键能够与溴发生加成反应;
(4)剩余气体为氢气、甲烷,根据摩尔质量在数值上等于相对分子质量,求出混合气体的平均相对分子质量.
(2)能使酸性高锰酸钾溶液褪色的物质有乙烯、丙烯和甲苯,但是只有甲苯在0℃是液态,依据甲苯中含不同氢原子种数判断一氯代物的种数;
(3)乙烯、丙烯均含有碳碳双键能够与溴发生加成反应;
(4)剩余气体为氢气、甲烷,根据摩尔质量在数值上等于相对分子质量,求出混合气体的平均相对分子质量.
解答:
解:(1)电石制备乙炔的方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑;乙炔加聚生成聚乙炔的化学方程式为:nC2H2→ ;
;
故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;nC2H2→ ;
;
(2)甲苯常温下是液态,能够使酸性的高锰酸钾褪色,甲苯中苯环上的一氯代物有3种,甲基上的一氯代物有1种,所以一氯代物共有4种;
故答案为:4;
(3)乙烯、丙烯均含有碳碳双键能够与溴发生加成反应,所以C中可以看到的现象是溶液褪色;
故答案为:溶液褪色;
(4)经溴水充分吸收再干燥后,剩余两种气体的成份为氢气和甲烷,
设混合气体的质量为100g,则氢气的质量为12g,物质的两为
=6mol,甲烷的质量为24g,物质的量为
=1.5mol,
混合气体的摩尔质量为:
=4.8g/mol,即平均相对分子质量为4.8,
故答案为:4.8.
故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;nC2H2→
(2)甲苯常温下是液态,能够使酸性的高锰酸钾褪色,甲苯中苯环上的一氯代物有3种,甲基上的一氯代物有1种,所以一氯代物共有4种;
故答案为:4;
(3)乙烯、丙烯均含有碳碳双键能够与溴发生加成反应,所以C中可以看到的现象是溶液褪色;
故答案为:溶液褪色;
(4)经溴水充分吸收再干燥后,剩余两种气体的成份为氢气和甲烷,
设混合气体的质量为100g,则氢气的质量为12g,物质的两为
| 12g |
| 2g/mol |
| 24g |
| 16g/mol |
混合气体的摩尔质量为:
| 12g+24g |
| 6mol+1.5mol |
故答案为:4.8.
点评:本题考查了常见有机物的结构和性质,明确物质结构和性质是解题关键,注意对课本基础知识的巩固,题目难度不大.

练习册系列答案
相关题目
下列反应中氯元素全部被还原的是( )
| A、MnO2+4HCl=MnCl2+2H2O+Cl2↑ | ||||
| B、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | ||||
| C、5Cl2+I2+6H2O=10HCl+2HIO3 | ||||
D、2NaCl+2H2O
|
下列化学用语表述一定正确的是( )
A、甲醛的电子式: | ||||
B、用铜电极做盐酸溶液的电解实验:2H+2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br-+OH
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列离子方程式表达正确的是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| B、碳酸氢钠溶液与过量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
| D、向明矾溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
下列说法正确的是( )
| A、3P2表示3P能级有两个轨道 |
| B、同一原子中1S、2S、3S电子的能量逐渐降低 |
| C、氢原子电子云的一个小黑点表示一个电子 |
| D、处于最低能量的原子叫基态原子 |
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.