题目内容
已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ?mol-1,则反应HCl(g)=
2H2(g)+
Cl2(g)的△H为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、+184.6kJ?mol-1 |
| B、+92.3kJ?mol-1 |
| C、-184.6kJ?mol-1 |
| D、-92.3kJ?mol-1 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:在热化学方程式中明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数;反应热与反应方程式相互对应.若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同;反应方向改变,焓变数值符号改变.
解答:
解:依据热化学方程式的书写原则和方法,已知热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ?mol-1,
改变方向,焓变变为正值,系数除以2,焓变也除以2,得到热化学方程式为HCl(g)=
H2(g)+
Cl2(g)△H=+92.3kJ?mol-1,
故选B.
改变方向,焓变变为正值,系数除以2,焓变也除以2,得到热化学方程式为HCl(g)=
| 1 |
| 2 |
| 1 |
| 2 |
故选B.
点评:本题考查了热化学方程式的书写方法和注意问题,熟练掌握书写原则是解题关键,题目较简单.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列有关化学反应速率的说法正确的是( )
| A、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B、100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小 |
| C、SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢 |
| D、对于CaCO3+2HCl═CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示 |
下列反应中氯元素全部被还原的是( )
| A、MnO2+4HCl=MnCl2+2H2O+Cl2↑ | ||||
| B、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | ||||
| C、5Cl2+I2+6H2O=10HCl+2HIO3 | ||||
D、2NaCl+2H2O
|
 已知X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的质子数是Y的2倍,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
已知X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的质子数是Y的2倍,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A、五种元素中原子半径最大的是X,离子半径最大的是Q离子 |
| B、五种元素中Q的最高价氧化物所对应的水化物的酸性最强 |
| C、Y与Z形成的化合物一定是碱性氧化物 |
| D、Z与Q形成的化合物水溶液一定显酸性 |
在2010年上海世博会上,清洁能源、低碳经济、节能减排等理念得到了充分体现.下列做法中不能体现上述理念的是( )
| A、某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| B、快餐盒用生物质材料“玉米塑料”(主要成分为可降解聚乳酸)做成 |
| C、使用的卫生纸都是再生纸 |
| D、把世博会期间产生的垃圾焚烧或深埋处理 |
在浓度均为6mol?L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A、11.2 g |
| B、25.2 g |
| C、16.8 g |
| D、33.6 g |
下列化学用语表述一定正确的是( )
A、甲醛的电子式: | ||||
B、用铜电极做盐酸溶液的电解实验:2H+2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br-+OH
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列离子方程式表达正确的是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| B、碳酸氢钠溶液与过量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
| D、向明矾溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
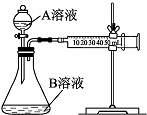 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.