题目内容
便携式电源广泛采用的锂离子电池正极材料(主要含有LiCoO2及少量Al、Fe等).某研究性学习小组为了回收钴和锂,设计实验流程如图1:
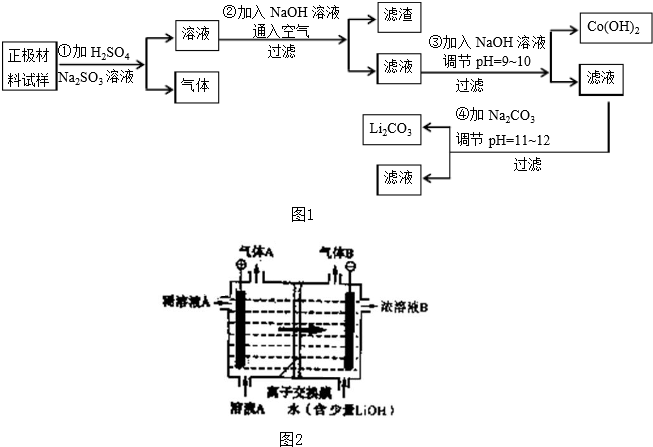
(1)第②步通入空气的目的是 ,滤渣的主要成分是 (填化学式).
(2)第①步反应的离子方程式是 +SO32-+ =Li++ + + .
(3)将第④步得到的Li2CO3粗品先溶于盐酸,并对此溶液A通过离子隔膜电解法进行提纯,装置如图2所示,再向所得浓溶液B中加入过量的NH4HCO3溶液,过滤,烘干得高纯Li2CO3.则气体A为 (填化学式),通过离子交换膜的离子为 (填离子符号).
(4)将第③步得到的Co(OH)2在空气中加热,完全变成Co3O4,经称量Co3O4的质量为4.82g,则第①步至少加入含 gNa2SO3的溶液.

(1)第②步通入空气的目的是
(2)第①步反应的离子方程式是
(3)将第④步得到的Li2CO3粗品先溶于盐酸,并对此溶液A通过离子隔膜电解法进行提纯,装置如图2所示,再向所得浓溶液B中加入过量的NH4HCO3溶液,过滤,烘干得高纯Li2CO3.则气体A为
(4)将第③步得到的Co(OH)2在空气中加热,完全变成Co3O4,经称量Co3O4的质量为4.82g,则第①步至少加入含
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:电池正极材料主要含有LiCoO2及少量Al、Fe等酸溶后加入亚硫酸钠溶液反应得到硫酸钴溶液和氢气,加入氢氧化钠溶液通入热的空气氧化亚铁离子为铁离子,使铁离子沉淀,铝离子完全沉淀,加入氢氧化钠溶液调节溶液PH=9-10过滤得到氢氧化钴沉淀,滤液中加入碳酸钠溶液调节溶液PH=11-12过滤得到碳酸锂;
(1)步骤②通入热的空气目的是将亚铁离子氧化为铁离子,调节溶液PH使铁离子和铝离子完全沉淀;
(2)第一步反应是LiCoO2和亚硫酸钠在酸溶液中发生氧化还原反应生成钴离子和硫酸盐;
(3)电解原理分析,与电源正极连接的是阳极,与电源负极连接的为阴极,将第④步得到的Li2CO3粗品先溶于盐酸,并对此溶液A通过离子隔膜电解法进行提纯,溶液中氯离子在阳极失电子生成氯气,阴极是氢离子得到电子生成氢气,锂离子移向阴极,离子交换膜为阳离子交换膜;
(4)阳极反应的离子方程式和钴元素守恒计算.
(1)步骤②通入热的空气目的是将亚铁离子氧化为铁离子,调节溶液PH使铁离子和铝离子完全沉淀;
(2)第一步反应是LiCoO2和亚硫酸钠在酸溶液中发生氧化还原反应生成钴离子和硫酸盐;
(3)电解原理分析,与电源正极连接的是阳极,与电源负极连接的为阴极,将第④步得到的Li2CO3粗品先溶于盐酸,并对此溶液A通过离子隔膜电解法进行提纯,溶液中氯离子在阳极失电子生成氯气,阴极是氢离子得到电子生成氢气,锂离子移向阴极,离子交换膜为阳离子交换膜;
(4)阳极反应的离子方程式和钴元素守恒计算.
解答:
解:电池正极材料主要含有LiCoO2及少量Al、Fe等酸溶后加入亚硫酸钠溶液反应得到硫酸钴溶液和氢气,加入氢氧化钠溶液通入热的空气氧化亚铁离子为铁离子,使铁离子沉淀,铝离子完全沉淀,加入氢氧化钠溶液调节溶液PH=9-10过滤得到氢氧化钴沉淀,滤液中加入碳酸钠溶液调节溶液PH=11-12过滤得到碳酸锂;
(1)步骤②通入热的空气目的是将亚铁离子氧化为铁离子,调节溶液PH使铁离子和铝离子完全沉淀,得到滤渣为Fe(OH)3、Al(OH)3;
故答案为:将Fe2+氧化为Fe3+;Fe(OH)3、Al(OH)3;
(2)第一步反应是LiCoO2和亚硫酸钠在酸溶液中发生氧化还原反应生成钴离子和硫酸盐,反应的离子方程式为:2LiCoO2+SO32-+6H+=2Li++2Co2++SO42-+3H2O;
故答案为:2LiCoO2;6H+;2Co2+;SO42-;3H2O;
(3)电解原理分析,与电源正极连接的是阳极,与电源负极连接的为阴极,将第④步得到的Li2CO3粗品先溶于盐酸,并对此溶液A通过离子隔膜电解法进行提纯,溶液中氯离子在阳极失电子生成氯气,阴极是氢离子得到电子生成氢气,锂离子移向阴极,离子交换膜为阳离子交换膜;
故答案为:Cl2;Li+;
(4)阳极反应的离子方程式:将第③步得到的Co(OH)2在空气中加热,完全变成Co3O4,经称量Co3O4的质量为4.82g,物质的量=
=0.02mol;
依据钴元素守恒可知,
2LiCoO2+SO32-+6H+=2Li++2Co2++SO42-+3H2O,
1 2
n 0.02mol×3
n=0.03mol
加入亚硫酸钠质量=0.03mol×126g/mol=3.78g;
故答案为:3.78.
(1)步骤②通入热的空气目的是将亚铁离子氧化为铁离子,调节溶液PH使铁离子和铝离子完全沉淀,得到滤渣为Fe(OH)3、Al(OH)3;
故答案为:将Fe2+氧化为Fe3+;Fe(OH)3、Al(OH)3;
(2)第一步反应是LiCoO2和亚硫酸钠在酸溶液中发生氧化还原反应生成钴离子和硫酸盐,反应的离子方程式为:2LiCoO2+SO32-+6H+=2Li++2Co2++SO42-+3H2O;
故答案为:2LiCoO2;6H+;2Co2+;SO42-;3H2O;
(3)电解原理分析,与电源正极连接的是阳极,与电源负极连接的为阴极,将第④步得到的Li2CO3粗品先溶于盐酸,并对此溶液A通过离子隔膜电解法进行提纯,溶液中氯离子在阳极失电子生成氯气,阴极是氢离子得到电子生成氢气,锂离子移向阴极,离子交换膜为阳离子交换膜;
故答案为:Cl2;Li+;
(4)阳极反应的离子方程式:将第③步得到的Co(OH)2在空气中加热,完全变成Co3O4,经称量Co3O4的质量为4.82g,物质的量=
| 4.82g |
| 241g/mol |
依据钴元素守恒可知,
2LiCoO2+SO32-+6H+=2Li++2Co2++SO42-+3H2O,
1 2
n 0.02mol×3
n=0.03mol
加入亚硫酸钠质量=0.03mol×126g/mol=3.78g;
故答案为:3.78.
点评:本题考查了物质分离和提纯的方法分析判断,电解池原理的应用离子方程式计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式表达正确的是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| B、碳酸氢钠溶液与过量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
| D、向明矾溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
下列物质属于强电解质的是( )
| A、H2CO3 |
| B、Cl2 |
| C、CaCO3 |
| D、NH3 |
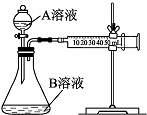 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.