题目内容
13.某饱和一元醛发生银镜反应时可以析出21.6g银,等量的醛完全燃烧可以产生8.96LCO2(标准状况),则该醛为( )| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |
分析 生成Ag的物质的量为:$\frac{21.6g}{108g/mol}$=0.2mol,若为甲醛,则HCHO~4Ag,故HCHO为0.05mol,根据碳元素生成二氧化碳为0.05mol,而等量的醛完全燃烧产生CO2为:$\frac{8.96L}{22.4L/mol}$=0.4mol>0.05mol,故不能为HCHO,根据R-CHO~2Ag计算醛的物质的量,根据碳原子守恒计算醛中C原子数目,饱和一元醛的通式是CnH2nO,进而确定分子式.
解答 解:生成Ag的物质的量为:n(Ag)=$\frac{21.6g}{108g/mol}$=0.2mol,若为甲醛,根据HCHO~4Ag可知HCHO的物质的量为:0.2mol×$\frac{1}{4}$=0.05mol,根据碳元素生成二氧化碳为0.05mol,而等量的醛完全燃烧产生CO2为:$\frac{8.96L}{22.4L/mol}$=0.4mol>0.05mol,则一定不是HCHO,
根据关系式R-CHO~2Ag可知,醛的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,根据碳原子守恒可知醛中C原子数目为$\frac{0.4mol}{0.1mol}$=4,
所以该饱和一元醛的分子式为C4H8O,为丁醛,
故选D.
点评 本题考查化学方程式计算,题目难度不大,明确反应对应的实质为解答关键,注意银镜反应中甲醛与Ag的比例关系,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
15.X酯完全燃烧生成CO2和水的物质的量之比为1:1,X经过水解得B和C,C氧化可得到B,则X酯为( )
| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
1.如表是元素周期表的一部分,针对表中元素,填写下列空白.
(1)Al3+的结构示意图为 .
.
(2)CO2中存在的化学键是共价键,CO2的电子式为 .
.
(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 .
.(2)CO2中存在的化学键是共价键,CO2的电子式为
 .
.(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
8.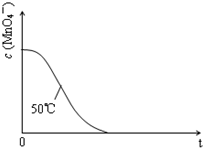 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移2mol 电子.为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥2.5.
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图(作相应标注).
 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案. | 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图(作相应标注).
5.如表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(2)写出结构简式
ACH2=CH2 CCH3CH2OH DCH3CHO
(3)判断E可能具有的性质是ABCDE(填字母)
A、能使酸性高锰酸钾褪色B、能使溴水褪色C、能与氢氧化钠反应 D、能与钠反应 E、能发生酯化反应.
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为 |
(1)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(2)写出结构简式
ACH2=CH2 CCH3CH2OH DCH3CHO
(3)判断E可能具有的性质是ABCDE(填字母)
A、能使酸性高锰酸钾褪色B、能使溴水褪色C、能与氢氧化钠反应 D、能与钠反应 E、能发生酯化反应.
2.热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol表示( )
| A. | 碳和水反应吸收131.3kJ 能量 | |
| B. | 1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量 | |
| C. | 1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ | |
| D. | 1 个固态碳原子和1 分子水蒸气反应吸热131.1kJ |
3.下列关于水的叙述错误的是( )
| A. | 自然界中的水都是混合物 | B. | 工业废水可直接排放 | ||
| C. | 水是生命活动不可缺少的物质 | D. | 肥皂水可以区分软水和硬水 |
