题目内容
4.下列叙述中,正确的是( )| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |
分析 A.胶体中滴加硫酸,先聚沉,且酸碱可发生中和反应;
B.加入铝粉能放出氢气的溶液,为非氧化性酸或强碱溶液;
C.醋酸在离子反应中保留化学式;
D.二者均与NaOH反应.
解答 解:A.向Fe(OH)3胶体中滴加硫酸,先聚沉,后发生复分解反应,则先出现红褐色沉淀,随后沉淀消失,故A正确;
B.加入铝粉能放出氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+,酸溶液中NO3-、Al发生氧化还原反应不生成氢气,故B错误;
C.食醋除去热水瓶水垢中CaCO3的离子方程式为CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O,故C错误;
D.二者均与NaOH反应,不能除杂,应选饱和碳酸钠溶液、分液除杂,故D错误;
故选A.
点评 本题考查较综合,涉及离子共存、离子反应及混合物分离提纯,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是( )
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)28 | ||
| C. | 在水溶液中(CN)2可被F-还原 | D. | HCN的电子式为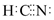 |
19.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
11.钒的氧化物有“化学面包”之美称,这是因为钒的氧化物是化学工业中的最佳催化剂之一.自然界中钒的同位素有51V和50V.下列有关说法中正确的是( )
| A. | ${\;}_{23}^{51}$V和${\;}_{23}^{50}$V互为同位素 | |
| B. | ${\;}_{23}^{51}$和${\;}_{23}^{50}$V的质量数相同 | |
| C. | ${\;}_{23}^{51}$V和${\;}_{23}^{50}$V是同一种核素 | |
| D. | ${\;}_{23}^{51}$V和${\;}_{23}^{50}$V的核外电子数与中子数均为23 |
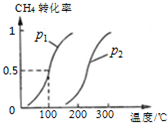 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料.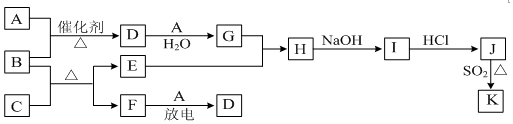
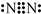
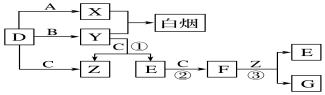
 A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.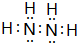 .
.
 如图是我校化学实验室浓盐酸试剂标签上的部分内容.
如图是我校化学实验室浓盐酸试剂标签上的部分内容.