题目内容
14. 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料.(1)已知:以甲烷为原料制取氢气是工业上常用的制氢方法.
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.4kJ•mol-1
①请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式:
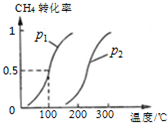
②将0.1mol CH4和0.2mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图:
已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为;图中的P1<P2(填“<”、“>”或“=”);
(2)分别将1molCO和2molH2置于恒容容器Ⅰ、恒压容器Ⅱ和恒容绝热容器Ⅲ中(三容器起始容积相同),在催化剂作用下自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.
①若起始温度相同,则达平衡时各容器中CH3OH含量由大到小的顺序:(填容器编号),达到平衡所需时间是I>Ⅱ(填“<”、“>”或“=”)
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为45%.
(3)甲烷直接合成乙酸具有重要的理论意义和应用价值.光催化反应技术使用CH4和(填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%).若室温下将amol•L-1的乙酸溶液和bmol•L-1Ba(OH)2溶液等体积混合,恢复室温后有2c(Ba2+)=c(CH3COO-),请用含a和b的代数式表示乙酸的电离平衡常数Ka=$\frac{2b×1{0}^{-7}}{a-2b}$.
分析 (1)①利用盖斯定律解答,从待求反应出发分析反应物生成物在所给反应中的位置,通过相互加减可得;
②根据图象判断100℃时甲烷的转化率,根据反应方程式及甲烷的物质的量计算出生成氢气的物质的量,再根据反应速率的表达式计算出用H2表示该反应的平均反应速率;转化率与温度、压强图象有三个变量,采用“定一议二”方法判断压强大小;
(2)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,正反应为气体体积减小的反应,随反应进行气体物质的量减小,I中压强减小,压强越大反应速率越快,Ⅱ中平衡等效再I中平衡基础上增大压强,平衡正向移动;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,即减少(1+2)mol×30%=0.9mol,利用差量法计算参加反应CO的物质的量,进而计算CO转化率;
(3)加成反应的原子利用率100%,根据电荷守恒判断c(CH3COO-)=2c(Ba2+)=bmol/L,再根据物料守恒计算出c(CH3COOH);
根据电荷守恒可得c(OH-)=c(H+),溶液显示中性;根据醋酸的电离平衡常数表达式及溶液中醋酸、醋酸根离子和氢离子浓度进行计算.
解答 解:(1)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1
由盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{\frac{1.5mol}{10L}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.0030mol•L-1•min-1;
③通过图表可知当温度相同时,p2→p1时,甲烷的转化率提高,平衡向正向移动,正向为气体系数增大的反应,根据减小压强平衡向系数增大的方向移动可知:p1<p2,故答案为:<;
(2)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,正反应为气体体积减小的反应,随反应进行气体物质的量减小,I中压强减小,压强越大反应速率越快,达到平衡需要的时间短,故达到平衡所需时间Ⅰ>Ⅱ,
故答案为:>;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,即减少(1+2)mol×30%=0.9mol,则:
CO(g)+2H2(g)?CH3OH(g)物质的量减小△n
1 2
0.45mol 0.9mol
则该容器中CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%;
(3)甲烷和二氧化碳之间反应生成乙酸,由于混合液为中性,则c(OH-)=c(H+),根据电荷守恒可得c(CH3COO-)=2c(Ba2+)=bmol/L,则溶液中醋酸的浓度为:c(CH3COOH)=0.5amol/L-c(CH3COO-)=(0.5a-b)mol/L;
反应平衡时溶液中c(CH3COO-)=2c(Ba2+)=bmol/L,根据电荷守恒可得c(OH-)=c(H+),所以溶液显示中性,常温下的中性溶液中c(OH-)=c(H+)=10-7mol/L,
醋酸的电离平衡常数为:K=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}×b}{0.5a-b}$=$\frac{2b×1{0}^{-7}}{a-2b}$.
故答案为:CO2;$\frac{2b×1{0}^{-7}}{a-2b}$.
点评 本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力、弱电解质电离平衡常数的计算等,综合性较大,题目难度中等,知识面广,应加强平时知识的积累.注意控制变量法与定一议二原则应用.

①氢氧化铁胶体②水③豆浆④蔗糖溶液⑤FeCl3溶液⑥云、雾.
| A. | ②④⑤ | B. | ③④ | C. | ②④⑥ | D. | ④①③ |
已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
| A. | 步骤①,最好用硫酸来溶解烧渣 | |
| B. | 步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+ | |
| C. | 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 | |
| D. | 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3 |
| A. | 升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动 | |
| B. | 若x=1,新平衡下E转化率为50% | |
| C. | 若x=2,新平衡下F的平衡浓度为0.5a mol/L | |
| D. | 若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短 |
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t3 时降低了温度 | |
| B. | t2时加入了催化剂 | |
| C. | t5时增大了压强 | |
| D. | t4~t5时间内 X 或 Y 的转化率最低 |
| A. | 在常温常压下,20mlNH3与60mlO2所含分子个数比为1:3 | |
| B. | 在化学反应中,1mol金属镁变为镁离子时失去电子数为NA | |
| C. | 在标准状况下,1mol水的体积为22.4L | |
| D. | 2molCaCl2中Cl-的数目为2NA |
| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |

 如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:
如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答: