题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,0.3mol三氧化硫中含有氧原子数为0.9NA | ||
B、aL甲烷和乙烷混合气体中的分子数为
| ||
| C、5.6 g铁与足量氯气或硫蒸气反应转移的电子数为0.3 NA | ||
| D、1L 1mol/L醋酸溶液中离子总数为2NA |
考点:阿伏加德罗常数
专题:
分析:A.1mol三氧化硫中含有3mol氧原子;
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
C.铁与硫蒸气反应生成的是亚铁离子,不是三价铁离子;
D.醋酸为弱酸,溶液中醋酸部分电离出氢离子和醋酸根离子.
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
C.铁与硫蒸气反应生成的是亚铁离子,不是三价铁离子;
D.醋酸为弱酸,溶液中醋酸部分电离出氢离子和醋酸根离子.
解答:
解:A.0.3mol三氧化硫中含有氧原子0.9mol,氧原子数为0.9NA,故A正确;
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,a L甲烷和乙烷混合气体中的物质的量不一定是
mol,故B错误;
C.由于铁与硫蒸气反应生成的是亚铁离子,5.6g铁物质的量是0.1mol,失去0.2mol电子,转移的电子数为0.2NA,故C错误;
D.1 L 1mol/L醋酸溶液中含有醋酸1mol,由于醋酸部分电离,则溶液中电离的离子小于2mol,溶液中离子总数小于2NA,故D错误.
故选A.
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,a L甲烷和乙烷混合气体中的物质的量不一定是
| a |
| 22.4 |
C.由于铁与硫蒸气反应生成的是亚铁离子,5.6g铁物质的量是0.1mol,失去0.2mol电子,转移的电子数为0.2NA,故C错误;
D.1 L 1mol/L醋酸溶液中含有醋酸1mol,由于醋酸部分电离,则溶液中电离的离子小于2mol,溶液中离子总数小于2NA,故D错误.
故选A.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项B为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对Fe(OH)3胶体和FeCl3溶液的比较,下列不正确的是( )
| A、可用丁达尔现象区别 |
| B、加入硫酸镁溶液前者会浑浊而后者无明显现象 |
| C、可用渗析的方法分离 |
| D、可用过滤的方法分离 |
如果按照某种标准能将FeSO4、Na2SO3、NO2划归为同一类物质,则下列物质中也能划归为此类物质的是( )
| A、KMnO4 |
| B、Al2(SO4)3 |
| C、KClO3 |
| D、K2HPO4 |
下列说法正确的是( )
| A、绿色食品就是指颜色为绿色的食品 |
| B、白色污染是指白色的废弃物的污染 |
| C、有机食品是指含有有机物的食品 |
| D、含有羧基的有机物能发生酯化反应 |
 是工业上常用的硫化剂,实验室制备的方法有2种:
是工业上常用的硫化剂,实验室制备的方法有2种: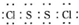 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下: