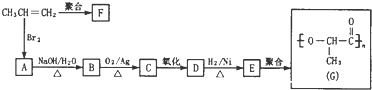
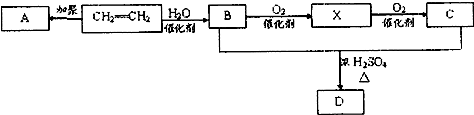
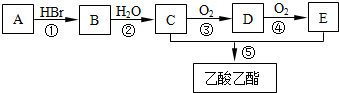
题目内容
在一体积固定的密闭 容器中,进行化学反应:2X(g)+Y(s)?Z(g)+W(g),若其化学平衡常数(K)和温度(℃)的关系如下表:对该反应而言,下列说法正确的是( )
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
| A、该反应正反应为放热反应 |
| B、K越大,反应物的转化率越大 |
| C、温度不变,增加X的用量,K增大 |
| D、达平衡后,加入催化剂,平衡向正反应方向移动 |
考点:用化学平衡常数进行计算
专题:
分析:A、根据温度的变化和K的关系来确定反应的吸放热情况;
B、K越大,说明反应进行的程度越大;
C、K只受温度的影响,可物质的量的增加没关系;
D、催化剂不会引起化学平衡的移动,只能改变反应速率.
B、K越大,说明反应进行的程度越大;
C、K只受温度的影响,可物质的量的增加没关系;
D、催化剂不会引起化学平衡的移动,只能改变反应速率.
解答:
解:A、根据图中内容知道:温度越高,反应的K越大,说明反应是吸热反应,故A错误;
B、根据平衡常熟K的意义:K越大,反应进行的程度越大,即反应物的转化率越大,故B正确;
C、K只受温度的影响,可物质的量的增加没关系,即温度不变,增加X的用量,K不变,故C错误;
D、催化剂不会引起化学平衡的移动,只能改变反应速率,即达平衡后,加入催化剂,平衡不会移动,故D错误.
故选B.
B、根据平衡常熟K的意义:K越大,反应进行的程度越大,即反应物的转化率越大,故B正确;
C、K只受温度的影响,可物质的量的增加没关系,即温度不变,增加X的用量,K不变,故C错误;
D、催化剂不会引起化学平衡的移动,只能改变反应速率,即达平衡后,加入催化剂,平衡不会移动,故D错误.
故选B.
点评:本题考查学生影响化学平衡移动的因素以及平衡常熟的意义,在解题中要注意知识的灵活应用和结论的归纳,难度中等.

练习册系列答案
相关题目
A、B、C、D、E五种元素同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下: ,下列说法中正确的是( )
,下列说法中正确的是( )
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、D元素的负化合价为-2价时,E元素的最高化合价一定为+7 |
| B、B(OH)m为强碱时,A(OH)n也一定为强碱 |
| C、HnDOm为强酸时,E的非金属性一定很强 |
| D、HnCOm为强酸时,E的单质可能有强还原性 |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
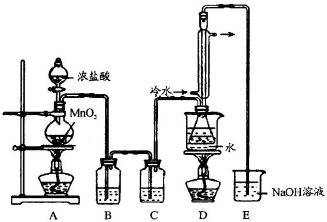 是工业上常用的硫化剂,实验室制备的方法有2种:
是工业上常用的硫化剂,实验室制备的方法有2种: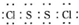 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下: