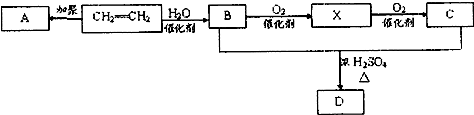
题目内容
A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍.
试回答:
(1)A、B、C、D四种元素依次是 (写出元素名称).
(2)写出A、C两元素最高价氧化物的水化物间反应的离子方程式 .
(3)请用电子式表示化合物A2D的形成过程: .
试回答:
(1)A、B、C、D四种元素依次是
(2)写出A、C两元素最高价氧化物的水化物间反应的离子方程式
(3)请用电子式表示化合物A2D的形成过程:
考点:位置结构性质的相互关系应用
专题:化学平衡专题
分析:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅤⅡA族元素,所以B为氯元素,A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,则A为钾元素,1molC单质与足量的稀硫酸反应可生成1.5molH2,则C为第ⅢA族元素,反应后C元素原子形成的离子和氖原子的电子层结构相同,所以C为铝元素,D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,且B、D的阴离子具有相同的电子层结构,则D为硫元素,据此答题;
解答:
解:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅤⅡA族元素,所以B为氯元素,A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,则A为钾元素,1molC单质与足量的稀硫酸反应可生成1.5molH2,则C为第ⅢA族元素,反应后C元素原子形成的离子和氖原子的电子层结构相同,所以C为铝元素,D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,且B、D的阴离子具有相同的电子层结构,则D为硫元素,
(1)由上面积分析可知,A、B、C、D四种元素依次是钾、氯、铝、硫,
故答案为:钾、氯、铝、硫;
(2)A的最高价氧化物的水化物氢氧化钾,C两元素最高价氧化物的水化物为氢氧化铝,它们反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
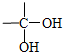
(3)A2D为K2S,用电子式表示化合物K2S的形成过程为 ,
,
故答案为: ;
;
(1)由上面积分析可知,A、B、C、D四种元素依次是钾、氯、铝、硫,
故答案为:钾、氯、铝、硫;
(2)A的最高价氧化物的水化物氢氧化钾,C两元素最高价氧化物的水化物为氢氧化铝,它们反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)A2D为K2S,用电子式表示化合物K2S的形成过程为
 ,
,故答案为:
 ;
;
点评:本题主要考查了元素化合物知识和电子式,难度不大,解题的关键在于元素的推断,答题时注意化学用语的规范表达.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
5.6g铁粉投入到盛有100mL 2mol/L稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
| A、v(Fe)=0.05 mol/(L?min) |
| B、v(H2SO4)=0.1 mol/(L?min) |
| C、v(H2SO4)=0.5 mol/(L?min) |
| D、v(FeSO4)=0.1 mol/(L?min) |
如果按照某种标准能将FeSO4、Na2SO3、NO2划归为同一类物质,则下列物质中也能划归为此类物质的是( )
| A、KMnO4 |
| B、Al2(SO4)3 |
| C、KClO3 |
| D、K2HPO4 |
在一种一元碱ROH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,下列判断中一定正确的是( )
| A、加入的一元酸HA过量 |
| B、生成的盐RA不能发生水解 |
| C、加入的酸与碱的物质的量相等 |
| D、反应后溶液中C(A-)=C(R+) |
A、B、C、D、E五种元素同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下: ,下列说法中正确的是( )
,下列说法中正确的是( )
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、D元素的负化合价为-2价时,E元素的最高化合价一定为+7 |
| B、B(OH)m为强碱时,A(OH)n也一定为强碱 |
| C、HnDOm为强酸时,E的非金属性一定很强 |
| D、HnCOm为强酸时,E的单质可能有强还原性 |
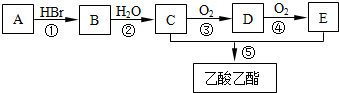
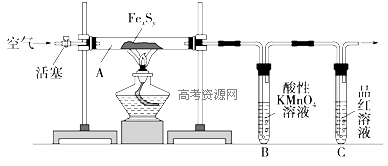
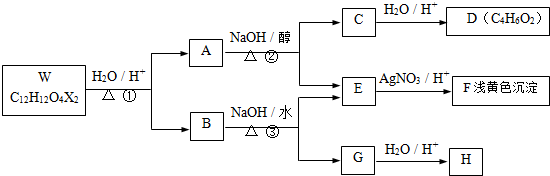
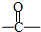
 ,反应④的化学方程式是
,反应④的化学方程式是