题目内容
9.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol 氖气含有的原子数为2NA | |
| C. | 27g Al与足量的盐酸反应失去的电子数为3NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数一定相同 |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、氦气为单原子分子;
C、求出铝的物质的量,然后根据反应后铝元素为+3价来分析;
D、同温同压下,相同体积的任何气体的物质的量相同,但单质气体分为单原子分子,双原子分子和多原子分子.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子个数小于0.5NA个,故A错误;
B、氦气为单原子分子,故1mol氖气中含1mol氖原子即NA个,故B错误;
C、27g铝的物质的量为1mol,而反应后铝元素为+3价,故1mol铝失去3mol电子即3NA个,故C正确;
D、同温同压下,相同体积的任何气体的物质的量相同,但单质气体分为单原子分子,双原子分子和多原子分子,故等物质的量的单质气体中含有的原子个数不一定相同,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
20.实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED;
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)下列配制的溶液浓度偏低的是ABC;
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
E.配制前,容量瓶中有少量蒸馏水.
(1)配制250mL 1.25mol/L的NaOH溶液
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)下列配制的溶液浓度偏低的是ABC;
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
E.配制前,容量瓶中有少量蒸馏水.
17. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{{a}^{2}}{(1-{a}^{2})}$p(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{{a}^{2}}{(1-{a}^{2})}$p(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用.
4.碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如图:
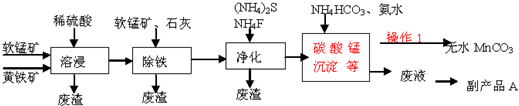
已知:几种金属离子沉淀的pH如表:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.

已知:几种金属离子沉淀的pH如表:
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
14.如表为元素周期表的一部分,根据信息,回答下列物问题.
(1)非金属性最强的元素是Na,
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A、碱性强弱:Mg(OH)2>NaOH B、氢化物稳定性:HF>HCl C、酸性强弱:H3PO4>H2SO4.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A、碱性强弱:Mg(OH)2>NaOH B、氢化物稳定性:HF>HCl C、酸性强弱:H3PO4>H2SO4.
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | 实验室制备氢氧化铁胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO22-+2H2O | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
18.在酸性溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、CH3COO-、NO3-、SO42- |