题目内容
17.某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝.查阅到以下资料:铝是银白色金属,熔点660.4℃,沸点2467℃;无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾.用于有机合成和石油工业的催化剂,以及用于处理润滑油等.他们设计了以下装置,请结合题意回答问题:
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O.
(2)装置B的作用是除去Cl2中的HCl气体,装置C中所盛试剂为浓H2SO4.
(3)请在标记为F的实线方框内画出合适的装置
 .
.(4)工业上制备金属Al,用电解熔融的Al2O3,而不使用熔融的AlCl3的原因是AlCl3是共价化合物,在熔融状态下不能电离出离子,不能导电,无法电解
(5)AlCl3遇潮湿空气即产生大量白雾的原因是(结合化学方程式说明).AlCl3遇水水解,发生如下反应:AlCl3+3H2O?Al(OH)3+3HCl,产生的HCl气体在空气中形成酸盐小液滴
(6)有同学认为该装置有不足之处,存在安全隐患.若你同意他的观点,请指出其不足之处连接D和E的导气管太细,生成的无水AlCl3易凝固导致导气管堵塞.
(7)反应后D得到氯化铝与铝粉的混合物,设计方案分离出纯净的氯化铝(简述分离原理和操作)铝的熔沸点高,氯化铝在177.8℃升华,所以利用加热升华后再凝华的方法得到纯净的氯化铝.
分析 浓盐酸和二氧化锰反应生成氯气,B中的饱和食盐水是为了除去混有的HCl气体,C中的浓硫酸是为了除去水,氯气与铝反应生成氯化铝,因为氯化铝易发生水解,故F应该防止空气中的水蒸气进入E装置和吸收尾气,以此解答该题.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ Cl2↑+MnCl2+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ Cl2↑+MnCl2+2H2O;
(2)B中的饱和食盐水是为了除去混有的HCl气体,C中为浓硫酸,目的是为了除去水,
故答案为:除去Cl2中的HCl气体;浓H2SO4;
(3)F应该防止空气中的水蒸气进入E装置和吸收尾气,可为 ,故答案为:
,故答案为: ;
;
(4)因AlCl3是共价化合物,在熔融状态下不能电离出离子,不能导电,无法电解,工业一般用熔融的氧化铝制备铝,
故答案为:AlCl3是共价化合物,在熔融状态下不能电离出离子,不能导电,无法电解;
(5)AlCl3遇水水解生成氢氧化铝和氯化氢,化学方程式:AlCl3+3H2O?Al(OH)3+3HCl,产生的HCl气体在空气中形成酸盐小液滴,
故答案为:AlCl3遇水水解,发生如下反应:AlCl3+3H2O?Al(OH)3+3HCl,产生的HCl气体在空气中形成酸盐小液滴;
(6)无水AlCl3在183℃时升华,遇潮湿空气即产生大量白雾,该装置存在安全隐患,连接D、E间导管太细,在生成、收集氯化铝的位置D、E间导管易发生堵塞,
故答案为:连接D和E的导气管太细,生成的无水AlCl3易凝固导致导气管堵塞;
(7)由题意可知铝是银白色金属,熔点660.4℃,沸点2467℃;无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,则可用升华的方法分离,
故答案为:铝的熔沸点高,氯化铝在177.8℃升华,所以利用加热升华后再凝华的方法得到纯净的氯化铝.
点评 本题考查物质的制备,为高频考点,侧重考查学生的分析能力和实验能力,注意把握实验的基本操作和实验原理以及实验的操作顺序,题目难度中等.

| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |

| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②设计实验来确定溶液X的成份,请补充完成实验步骤和现象
| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)O2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是d填标号).
a.明矾 b.碘化钾 c.盐酸d.硫酸亚铁.
 将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJ•mol-1,计算H-F键的键能为565kJ•mol-1.
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ.mol-1) | 414 | 489 | ? | 155 |
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32--12e-═8CO2+3H2O.写出该燃料电池的正极反应式O2+4e-+2CO2=2CO32-;.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2.某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式Co2+-e-=Co3+.
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气.
①电解池中电极A、B均为惰性电极,其中A为电解池的阳极;电极B所得到的物质X的分子式为H2.
②反应池中发生的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+.

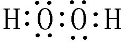 ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程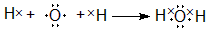 ;
; ,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为
,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为 ,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.
,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.
 ,反应②的反应类型为消去反应.
,反应②的反应类型为消去反应.