题目内容
 原子序数为16的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则下列说法错误的是( )
原子序数为16的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则下列说法错误的是( )| A、A元素的最高价氧化物为P2O5 |
| B、C元素原子核外有17个电子 |
| C、B元素的原子序数为8 |
| D、D元素的原子序为为24 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:原子序数为16的元素E为S元素,根据元素在周期表中的位置知,A是P、B是O、C是Cl、D是Se元素,
A.主族元素最高正化合价与其族序数相等(O、F元素除外);
B.原子中原子序数与核外电子数相等;
C.B和E原子序数相差8;
D.E和D元素原子序数相差18.
A.主族元素最高正化合价与其族序数相等(O、F元素除外);
B.原子中原子序数与核外电子数相等;
C.B和E原子序数相差8;
D.E和D元素原子序数相差18.
解答:
解:原子序数为16的元素E为S元素,根据元素在周期表中的位置知,A是P、B是O、C是Cl、D是Se元素,
A.A元素位于第VA族,其最高正化合价为+5价,所以其最高价氧化物为P2O5,故A正确;
B.原子中原子序数与核外电子数相等,C元素原子序数是17,则C原子核外有17个电子,故B正确;
C.B和E原子序数相差8,E原子序数是16,则B原子序数是8,故C正确;
D.E和D元素原子序数相差18,E原子序数是16,则E原子序数是34,故D错误;
故选D.
A.A元素位于第VA族,其最高正化合价为+5价,所以其最高价氧化物为P2O5,故A正确;
B.原子中原子序数与核外电子数相等,C元素原子序数是17,则C原子核外有17个电子,故B正确;
C.B和E原子序数相差8,E原子序数是16,则B原子序数是8,故C正确;
D.E和D元素原子序数相差18,E原子序数是16,则E原子序数是34,故D错误;
故选D.
点评:本题考查了元素周期表和元素周期律综合应用,明确原子结构和元素周期表结构是解本题关键,注意:第VIA族相邻元素原子序数相差原子序数大的元素所在周期元素种类数,题目难度中等.

练习册系列答案
相关题目
下图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )


| A、W、R元素单质分子内的都存在非极性键 |
| B、X、Z元素都能形成双原子分子 |
| C、键能W-H<Y-H,键的极性Y-H>W-H |
| D、键长X-H<W-H,键能X-H<W-H |
天然气是一种高效、低能耗、污染小的清洁能源.天然气的主要成分是( )
| A、CH2=CH2 |
| B、CO |
| C、CH4 |
| D、H2 |
汽水是CO2的饱和溶液,其中存在如下平衡H2CO3?H++HCO
…①HCO
?H++CO
…②将汽水倒入试管中分别进行下列实验,相应分析结论错误的是( )
- 3 |
- 3 |
2- 3 |
| A、加热、平衡①、②可能都向左移动 |
| B、加入澄清石灰水,平衡①、②均向右移动 |
| C、加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动 |
| D、通入过量CO2或滴加氯水,溶液PH均减小 |
下列说法不正确的是( )
| A、1g氢气在氧气中完全燃烧生成气态水,放出热量120.9kJ,氢气的燃烧热大于241.8kJ?mol-1 | |||
B、500℃30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |||
| D、已知中和热为-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列说法错 误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列说法错 误的是( )| A、Z的氧化物与W的氧化物的化学键类型相同 |
| B、X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中 |
| C、最高价氧化物对应水化物稀溶液的氧化性:W<Z |
| D、Y原子的半径比W原子的半径大 |
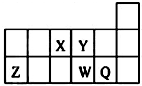 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、Z的氧化物能与水反应 |
| C、离子Y2-和Z3+的核外电子数和电子层数都相同 |
| D、元素Y的氢化物的稳定性比W的氢化物强 |
下列离子方程式正确的是( )
| A、NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ |
| B、Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ |
| C、向FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
