题目内容
写出[Ag(NH3)2]OH的中心原子、配位原子和配位数.
中心原子(离子):
配位原子(分子):
配位数: .
中心原子(离子):
配位原子(分子):
配位数:
考点:配合物的成键情况
专题:化学键与晶体结构
分析:配合物[Ag(NH3)2]OH中,Ag+为中心离子,NH3为配体,根据配体的个数判断配位数,据此分析解答.
解答:
解:配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配合物中中心原子提供空轨道,配体提供孤电子对;配合物[Ag(NH3)2]OH中,Ag+为中心离子,NH3为配体,配位数为2;
故答案为:Ag+;NH3;2.
故答案为:Ag+;NH3;2.
点评:本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,特别注意配体和外界离子的区别,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3 NA |
| B、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA |
| C、CO2通过Na2O2使其增重bg时,反应中转移的电子数为bNA/44 |
| D、1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA |
下列无色澄清的溶液中,可能大量共存的离子组是( )
| A、[Ag(NH3)2]+、K+、OH-、 |
| B、Fe3+、Cl-、I- |
| C、H+、Al3+、F- |
| D、ClO-、Na+、S2- |
 如图是我国“长征二号F”运载火箭发射现场.图中可以看到从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是( )
如图是我国“长征二号F”运载火箭发射现场.图中可以看到从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是( )| A、是溴蒸气,火箭发射时作氧化剂 |
| B、是二氧化氮气体,火箭发射时作还原剂 |
| C、是溴蒸气,火箭发射时作还原剂 |
| D、是二氧化氮气体,火箭发射时作氧化剂 |

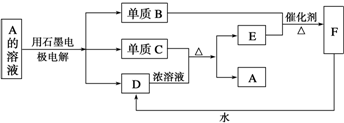
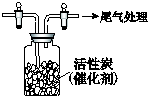 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.