题目内容
6.下列离子方程式书写正确的是( )| A. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 4 mol•L-1的KAl(SO4)2溶液与7 mol•L-1的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O | |
| D. | 食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
分析 A.硝酸银溶液中滴加过量氨水,得到银氨溶液;
B.硫氢根离子部分水解生成硫化氢和氢氧根离子,溶液显示碱性;
C.KAl(SO4)2与Ba(OH)2反应,SO42-+Ba2+=BaSO4↓,当Ba(OH)2过量,Al3++4OH-=AlO2-+2H2O,当KAl(SO4)2过量,Al3++3OH-=Al(OH)3↓,根据两者的量进行判断;
D.食醋为乙酸属于弱电解质,应写化学式.
解答 解:A.滴加氨水至过量,得到银氨溶液,离子反应为Ag++2NH3•H2O=Ag(NH3)2++2H2O,故A错误;
B.NaHS溶液呈碱性的原因是硫氢根离子部分水解所致,正确的离子方程式为:HS-+H2O?H2S+OH-,故B错误;
C.4mol•L-1的KAl(SO4)2溶液与7mol•L-1的Ba(OH)2溶液等体积混合,假设溶液的体积为1L,则Al3+为4mol,SO42-为8mol,OH-为14mol,所以Al(OH)3与AlO2-比为1:1,则离子反应方程式为:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O,故C正确;
D.食醋除水垢中的碳酸钙的离子反应为CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应的实质为解答本题的关键,注意掌握水解原理与弱电解质的电离的区别,C是解答难点,注意量与产物间的关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 钢铁的电化学腐蚀和化学腐蚀往往同时发生 | |
| B. | 反应C(s)+H2O(g)═CO(g)+H2(g)的△S>0、△H<0 | |
| C. | 常温下,pH为5的氯化铵溶液和pH为9的醋酸钠溶液中水的电离程度相同 | |
| D. | 向BaSO4沉淀中加入饱和Na2CO3溶液后生成BaCO3,则Ksp(BaCO3)<Ksp(BaSO4) |
17.一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )
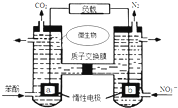

| A. | a电极发生还原反应,做原电池的正极 | |
| B. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 标准状况下,电路中产生6moLCO2同时产生22.4L的N2 |
14.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O32- | |
| B. | 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- | |
| C. | 0.1mol/LFe(NO3)2溶液:S2-、Na+、SO42-、Cl- | |
| D. | 0.1mol/LNaAlO2溶液:NH4+、K+、HCO3-、SO32- |
1.自1932年由美国物理学家卡尔•安德森在实验中证实了反粒子的存在之后,反物质领域一直成为科学家致力研究的一个重点.“反物质”理论提出:每一种粒子都有一个和它的质量、寿命、自旋严格相等,而电性相反的反粒子.著名的物理学家狄拉克曾大胆地提出了一个假说:存在着一个“反物质”的世界.表为“反物质”的世界中元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍.据此,下列说法中错误的是( )
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | Y、Z、B、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
11.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| B. | pH=8.3的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中:c(Cl-)=c(I-) | |
| D. | 0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后所得溶液中:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)