题目内容
19.由合成气制备乙醇一般有两种方法:(1)直接合成法
①2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1
②2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇.其生产流程如下图所示:

③3CO(g)+3H2(g)?CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1
④CH3OCH3(g)+CO(g)?CH3COOCH3(g)
⑤CH3COOCH3(g)+2H2(g)?CH3OH(g)+CH3CH2OH(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:

①反应①的△H1<0,△S<0.(填“>”、“<”或“=”)
②已知CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1,则△H1=-171.6kJ•mol-1.
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线.
(2)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%.则氢气的反应速率v(H2)=1.5/tmol•L-1•min-1,平衡常数K=9.
分析 (1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;气体的体积减小,△S<0;
②利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的,根据目标方程改写分方程,然后求出反应热;
③在t1min时升温到600K,平衡逆向移动,从图1可知达平衡时H2O%大于40%小于45%,据此画出体系中水的体积分数在t1min后的变化曲线;
(2)反应⑤为CH3COOCH3+2H2?CH3CH2OH+CH3OH,据此结合V=$\frac{△C}{△t}$计算氢气的反应速率,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值.
解答 解:(1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)正反应为气体的体积减小的反应,所以△S<0,
故答案为:<;<;
②Ⅰ2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1
Ⅱ2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
ⅢCO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1,将Ⅱ-Ⅲ×2得Ⅰ,所以△H1=(-253.6kJ•mol-1)-(-41kJ•mol-1)×2=-171.6kJ•mol-1,故答案为:-171.6kJ•mol-1;
③2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1=-171.6kJ•mol-1,在t1min时升温到600K,平衡逆向移动,水的体积分数下降,从图1可知达平衡时H2O%大于40%小于45%,图象为: ,
,
故答案为: ;
;
(2)乙酸甲酯加氢得到乙醇.反应⑤为CH3COOCH3+2H2?CH3CH2OH+CH3OH,
CH3COOCH3+2H2?CH3CH2OH+CH3OH
起始(mol/L):1 2 0 0
转化(mol/L):0.75 1.5 0.75 0.75
平衡(mol/L):0.25 0.5 0.75 0.75
氢气的反应速率V(H2)=$\frac{△C}{△t}$=$\frac{1.5}{t}$mol•L-1•min-1
平衡常数K=$\frac{C(C{H}_{3}C{H}_{2}OH)×C(C{H}_{3}OH)}{C(C{H}_{3}COOC{H}_{3})×{C}^{2}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.{5}^{2}}$=9
故答案为:1.5/t mol•L-1•min-1;9.
点评 本题涉及热化学、化学反应速率和平衡的有关计算和判断知识,属于综合知识的考查题,注意化学平衡的三段式计算应用,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 4 mol•L-1的KAl(SO4)2溶液与7 mol•L-1的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O | |
| D. | 食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知浓度的盐酸溶液时,锥形瓶使用前中含有少量水 | |
| D. | 用标准盐酸测定未知浓度NaOH溶液,结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
| A. | C2H2、HClO、C2H6 | B. | CO2、N2O、HC≡CH | ||
| C. | C6H5CH3、C3H4、CH4 | D. | C6H6、C2H4、HCN |
 b.
b.
 f.HOOC(CH2)4COOH
f.HOOC(CH2)4COOH 、
、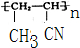
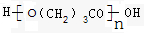
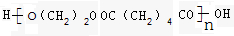 .
.

 CH2CH2CHO)的路线流程图.
CH2CH2CHO)的路线流程图.
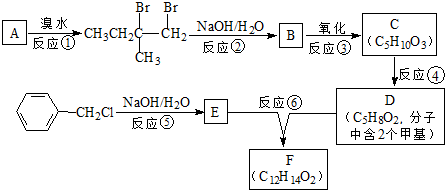
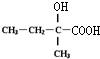
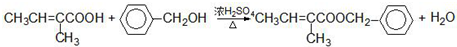 .
.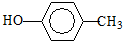 :
: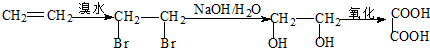 .
.