题目内容
17.一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )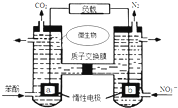
| A. | a电极发生还原反应,做原电池的正极 | |
| B. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 标准状况下,电路中产生6moLCO2同时产生22.4L的N2 |
分析 A、a是负极,发生氧化反应;
B、b极上N元素的化合价降低,所以b是正极发生还原反应,2NO3-+10e-+12H+═N2↑+6H2O;
C、原电池中阳离子从负极移向正极;
D、根据两极得失电子数目相等进行计算.
解答 解:A、a是负极,发生氧化反应,故A错误;
B、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,故B正确;
C、原电池中阳离子从负极移向正极,即H+由左室通过质子交换膜进入右室,故C错误;
D、电路中产生6moLCO2时,转移28mol电子,根据2NO3-+10e-+12H+═N2↑+6H2O,产生2.8mol氮气,标况下的体积为62.7L,故D错误.
故选B.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
7.某温度下,已知醋酸的电离常数Ka=1.8×10-5,醋酸银的溶度积常数Ksp=1.6×10-3,碳酸银的溶度积常数Ksp=8.3×10-12,在不考虑盐类水解的情况下,下列有关说法正确的是( )
| A. | 该温度下醋酸银的溶解度约为0.668g | |
| B. | 该温度下饱和醋酸水溶液的pH=2.5-$\frac{1}{2}$lg1.8 | |
| C. | 某溶液中含有CH3COO-和CO32-,浓度均为0.01mol/L,向其中逐滴加入0.01 mol/L的AgNO3溶液,CH3COO-离子先产生沉淀 | |
| D. | 醋酸溶液加水稀释后,溶液中导电粒子的数目减少 |
5.镇痛剂M(苯佐卡因)结构简式如图.下列说法正确的是( )
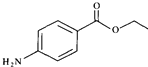

| A. | M分子式为C8H11NO2 | |
| B. | 1 mol M与NaOH溶液反应消耗1 mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
12.某中性有机物(分子式为C10H20O2)在稀硫酸作用下加热得M和N两种有机物,且M在酸性KMnO4溶液作用下可直接得到N.下列说法正确的是( )
| A. | M的分子式为C5H10O | |
| B. | 上述过程发生的所有反应与油脂皂化反应类型相同 | |
| C. | 该中性有机物有4种(不考虑立体异构) | |
| D. | M和N都可以发生取代反应、都能与Na反应生成H2,因此具有相同的官能团 |
6.下列离子方程式书写正确的是( )
| A. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 4 mol•L-1的KAl(SO4)2溶液与7 mol•L-1的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O | |
| D. | 食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑ |




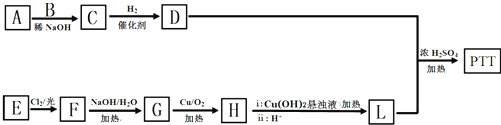
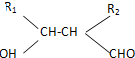
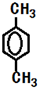 .
.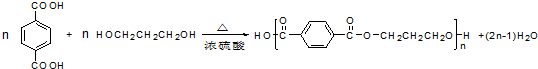 .
.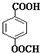 (填结构简式).
(填结构简式).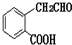 和CH3OH为有机原料制备化合物
和CH3OH为有机原料制备化合物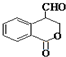 的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$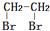 )
) .
. b.
b.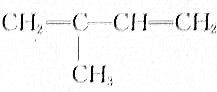
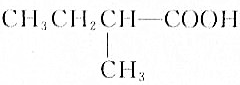 f.HOOC(CH2)4COOH
f.HOOC(CH2)4COOH 、
、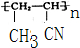
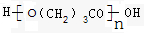
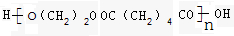 .
.